
الجدول الدوري
 المؤلف:
فريدريك بوش ، دافيد جيرد
المؤلف:
فريدريك بوش ، دافيد جيرد
 المصدر:
اساسيات الفيزياء
المصدر:
اساسيات الفيزياء
 الجزء والصفحة:
ص 1055
الجزء والصفحة:
ص 1055
 10-7-2016
10-7-2016
 1990
1990
الجدول الدوري
لم نتناول حتى الآن ــ باهتمام ــ سوى ذرة بها إلكترون واحد فحسب؛ وهي قد تكون ذرة هيدروجين، أو ذرة هليوم وحيدة التأين، أو ذرة ليثيوم ثنائية التأين، وهكذا. ولكننا الآن في وضع يسمح لنا بدراسة كيفية ترتيب الإلكترونات الإضافية داخل ذرات متعددة الإلكترونات كالتي توجد في الطبيعة ويضعها الجدول الدوري للعناصر. ولكي تفعل هذا، سنلجأ مرة اخرى ــ إلى مفهوم القشرات ( أو الإغلقة) الإلكترونية التي تحيط بالنواة؛ حيث لكل قيمة من العدد n قشرة مصاحبة له. وسنعتبر ــ بالإضافة إلى ذلك ــ أن نفس حالات الرنين التي أوجدناها للذرة ذات الإلكترون الاوحد، يمكن إجراؤها وصفياً لذرات أكثر تعقيداً. ومعنى هذا، إننا نستخدم الحالات الإلكترونية التي تتحدد بالأعداد الكمية الأربعة.
إن السؤال الذي يطرح نفسه الآن هو: "كيف تقوم الإلكترونات بترتيب أنفسها في الحالات المختلفة، عندما يكون بالذرة أكثر من إلكترون؟ " إن ذرة الكربون ــ مثلاً لديها ستة إلكترونات، ففي أي مستويات الطاقة والحالات الإلكترونية على هذه الإلكترونات أن تتواجد؟ نستطيع الإجابة على هذا السؤال باستخدام القواعد الثلاث التالية:
1ـ إن عدد الإلكترونات في أية ذرة متعادلة ، يساوي العدد الذري Z لتلك الذرة.
2- جميع الإلكترونات في ذرة غير مستثارة، موجودة في أدنى حالات ممكنة للطاقة. ويقال عندئذ أن الذرة في حالتها الأرضية.
3- لا يمكن لأي إلكترونين في ذرة ما أن يتخذا نفس الأعداد الكمية الأربعة (حسب مبدأ بأولى للاستبعاد).
هيا بنا الآن نستخدم هذه القواعد لكي نعين التركيب الإلكتروني للذرات عير المستثارة في الجدول الدوري.
الهيدروجين (Z = 1)
سيتواجد الإلكترون المنفرد لهذه الذرة في المستوى n =1، وهو أدنى مستوى ممكن للطاقة، وبهذا لا يكون مبدأ بأولى للاستبعاد قد خرق.
الهليوم (Z = 2)
يستطيع إلكتروناً هذه الذرة أن يتواجدا في المستوى n =1، وذلك لكونهما يستطيعان اتخاذ أعداداً كمية غير متطابقة كما هو موضح في الجدول 1))، الذي تندرج به مجموعات الأعداد الكمية الممكنة فقط بالنسبة للمستوى n =1. ولا يمكن لأي إلكترون ثالث أن يتواجد في هذا المستوى. ويطلق على كل قيمة للعدد n قشرة طاقة، ويقال أن القشرة n =1 تكون ممتلئة إذا احتلها إلكتروناً فحسب.
الليثيوم (Z = 3)
لها الذرة ثلاث إلكترونات ولذلك لابد للإلكترون الثالث من أن يتجه إلى أعلى قشرة طاقة تالية، أو التي عندها n =2 (انظر الجدول (1)). وحيث أن هذا الإلكترون موجود في مستوى الطاقة الثاني، فإن ارتباطه بالذرة يكون أضعف من تلك التي في الحالة n =1. وعلى ذلك يستطيع الليثيوم أن يشارك بإلكترون واحد في التفاعلات الكيميائية بسهولة ويسر. ولذلك يطلق على الليثيوم، عنصر احادي التكافؤ حسب المصطلحات الكيميائية (أو الذي تكافؤه واحد).
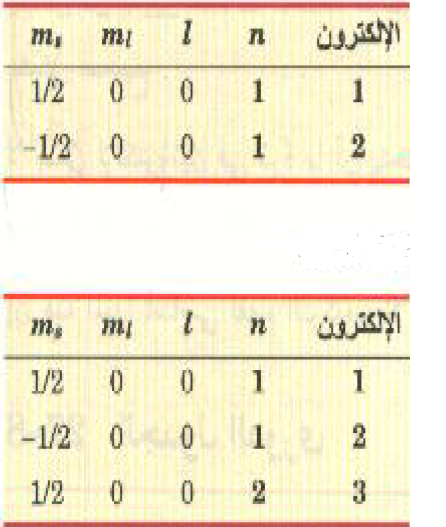
الجدول (1)
الذرات التي لها قيم Z أكبر من 3
هناك عدد قليل من المجموعات الممكنة من الأعداد الكمية عندما تكون n =2 وستجد أنها ثماني مجموعات إذا قمت بعدها. ومعنى ذلك أن القشرة n =2 يمكن أن يتواجد فيها ثمانية إلكترونات. أي أن القشرة لن تمتلئ تماماً إلى أن نصل إلى العنصر Z = 10 وهو النيون، الذي يعد خاملاً من الناحية الكيميائية لأن قشراته ممتلئة. والعنصر الذي يأتي بعده هو الصوديوم Z =11، وذرته أحادية التكافؤ لأن إلكتروناً الحادي عشر سيكون وحيداً بالقشرة n =3 ومن السهل إبعاده عن الذرة.
وكلما تقدمنا نحو العناصر ذات القيم الكبيرة للعدد الذري Z في الجدول كلما قلت جدوى مفهوم القشرات، ويعود ذلك إلى أن التباعد بين مستويات الطاقة صغير نسبياً عند قيم n الكبيرة. وفي هذه الحالات قد يؤدى التنافر بين الإلكترونات المختلفة في الذرة ــ أحياناً ــ إلى وجود طاقات من الكبر بحيث تلغى تأثير فروق الطاقة الموجودة بين القشرات وعلى الرغم من ظهور هذه المشكلة، يظل مفهوم القشرة ــ كما ثبت ذلك مفيداً للاعتبارات الوصفية.
 الاكثر قراءة في الفيزياء الكيميائية
الاكثر قراءة في الفيزياء الكيميائية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


