
تاريخ الفيزياء

علماء الفيزياء


الفيزياء الكلاسيكية

الميكانيك

الديناميكا الحرارية


الكهربائية والمغناطيسية

الكهربائية

المغناطيسية

الكهرومغناطيسية


علم البصريات

تاريخ علم البصريات

الضوء

مواضيع عامة في علم البصريات

الصوت


الفيزياء الحديثة


النظرية النسبية

النظرية النسبية الخاصة

النظرية النسبية العامة

مواضيع عامة في النظرية النسبية

ميكانيكا الكم

الفيزياء الذرية

الفيزياء الجزيئية


الفيزياء النووية

مواضيع عامة في الفيزياء النووية

النشاط الاشعاعي


فيزياء الحالة الصلبة

الموصلات

أشباه الموصلات

العوازل

مواضيع عامة في الفيزياء الصلبة

فيزياء الجوامد


الليزر

أنواع الليزر

بعض تطبيقات الليزر

مواضيع عامة في الليزر


علم الفلك

تاريخ وعلماء علم الفلك

الثقوب السوداء


المجموعة الشمسية

الشمس

كوكب عطارد

كوكب الزهرة

كوكب الأرض

كوكب المريخ

كوكب المشتري

كوكب زحل

كوكب أورانوس

كوكب نبتون

كوكب بلوتو

القمر

كواكب ومواضيع اخرى

مواضيع عامة في علم الفلك

النجوم

البلازما

الألكترونيات

خواص المادة


الطاقة البديلة

الطاقة الشمسية

مواضيع عامة في الطاقة البديلة

المد والجزر

فيزياء الجسيمات


الفيزياء والعلوم الأخرى

الفيزياء الكيميائية

الفيزياء الرياضية

الفيزياء الحيوية

الفيزياء العامة


مواضيع عامة في الفيزياء

تجارب فيزيائية

مصطلحات وتعاريف فيزيائية

وحدات القياس الفيزيائية

طرائف الفيزياء

مواضيع اخرى
قاعدة الطور
المؤلف:
بيتر أتكينز
المصدر:
الكيمياء الفيزيائية
الجزء والصفحة:
ص 78 – ص 81
2024-10-01
2558
أحد الجوانب الخاصة جدًّا للغليان والتجمد هو الاستنتاج الذي توصلت إليه الديناميكا الحرارية فيما يتعلق بحالات الاتزان بين الأشكال المختلفة للمادة. هذه هي «قاعدة الطور» التي وضعها جوسايا جيبس، وهي واحدة من أروع الاستنتاجات في الديناميكا الحرارية الكيميائية على الإطلاق. وقد صاغها في أواخر سبعينيات القرن التاسع عشر، وهو العصر الذهبي للديناميكا الحرارية الكيميائية.
«الطور» هو أحد أشكال المادة مثل الحالة السائلة أو الصلبة أو الغازية. وهو أكثر تحديدًا من «الحالة الفيزيائية» لأن المادة الصلبة قد توجد في عدة أطوار مختلفة. على سبيل المثال، يُعد الجرافيت طورًا صلبًا من الكربون، والألماس طورًا آخر منه. والهيليوم هو العنصر الوحيد المعروف بأنه يحظى بطورين سائلين، أحدهما سائل تقليدي والآخر مائع فائق، ينساب بدون لزوجة ولا توجد مادة تحظى بأكثر من طور غازي واحد. ويكون أي طور خاص بمادة هو الطور الأكثر استقرارًا في ظل نطاق معين من قيم الضغط ودرجة الحرارة. على سبيل المثال، يُعد الطور الصلب التقليدي للماء (الثلج العادي؛ في الحقيقة يوجد نحو 12 شكلًا مختلفًا من الثلج) الطور الأكثر استقرارًا الخاص به عند ضغط مقداره 1 ضغط جوي ودرجات حرارة تقل عن صفر درجة مئوية، ويكون الطور الغازي («بخار الماء») هو الطور الأكثر استقرارًا الخاص به عند ضغط مقداره 1 ضغط جوي ودرجات حرارة تزيد عن 100 درجة مئوية. ونقصد بعبارة «الأكثر استقرارًا» هنا أن الطور يحظى بأقل جهد كيميائي وجميع الأطوار الأخرى، ذات الجهد الكيميائي الأعلى، تتمتع بميل تلقائي للتحول إليه. ومن ثم، يمكن رسم خريطة باستخدام الضغط ودرجة الحرارة باعتبارهما إحداثيين يُبيِّنان مناطق الضغط ودرجة الحرارة التي يكون عندها كل طور الأكثر استقرارًا. وثمة تشبيه يتمثل في خريطة قارية؛ حيث إن كل بلد أو دولة تمثل نطاقات الضغط ودرجات الحرارة التي يكون عندها الطور المكافئ الأكثر استقرارًا (انظر شكل 5–2). يُطلق على هذا المخطط «مخطط الطور» وله أهمية كبرى في علم المواد، لا سيما عندما يتكون النظام قيد الدراسة من أكثر من مكون واحد (الحديد وعدة أنواع من الفولاذ مثلا).
تعد الخطوط الراسمة للحدود في مخطّط الطور مواضع خاصة، أشبه تماما بالحدود الفاصلة بين القارات على أرض الواقع. وفي مخطط الطور، هي تمثل الظروف التي بموجبها يكون طوران متجاوران في حالة اتزان. على سبيل المثال، يبين الخط الفاصل بين السائل والبخار ظروف الضغط ودرجة الحرارة التي يصل فيها الطوران إلى حالة الاتزان ومن ثم يمكن اعتباره رسم بياني لدرجة حرارة الغليان مقابل الضغط.
توجد عادةً مواضع في مخطط الطور، تماما كما هي الحال في الخرائط الخاصة بالقارات، حيث تلتقي الأطوار الثلاثة عند هذه النقطة التي يُطلق عليها «النقطة الثلاثية»
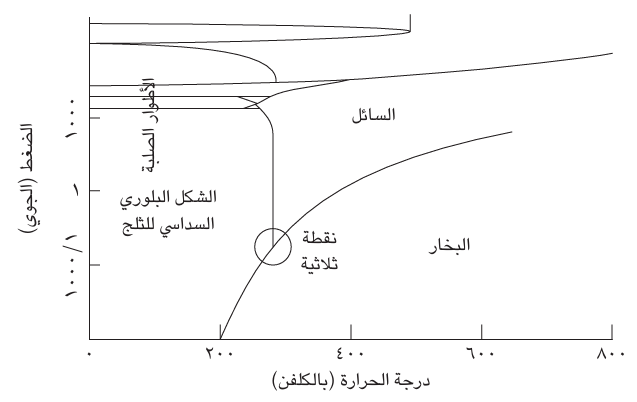
شكل 5–2: يُظهر مخطط الطور، الخاص بالماء هذه الحالة، مناطق الضغط ودرجة الحرارة التي يكون فيها كل طور الأكثر استقرارًا. وتوجد أشكال كثيرة للثلج. الشكل البلوري السداسي هو أكثرها شيوعًا.
تكون الأطوار الثلاثة في حالة اتزان متبادل، وثمة عمليات مستمرة بلا توقف لتبادل الجزيئات بين جميع الأطوار الثلاثة بمعدلات متطابقة. والنقطة الثلاثية لمادة ما، الماء مثلًا، هي نقطة تحددها الطبيعة وفي كل مكان بالكون (بحسب افتراضنا) تكون لها نفس القيمة تمامًا. في الواقع، لقد استخدمت النقطة الثلاثية للماء لتحديد مقياس كلفن لدرجة الحرارة، لتكون 273.16 كلفن بالضبط (في الشكل الحالي للتعريف)، وبدوره يُستخدم ذلك التعريف لتحديد مقياس درجة الحرارة المئوية اليومية بواقع درجة الحرارة على مقياس كلفن ناقص 2731 (أجل 2735، وليس 273.16).
كانت مساهمة جيبس في فهم مخططات الطور هيا استخلاص قاعدة بسيطة للغاية، وهي «قاعدة الطور»، لتفسير بنية أي مخطط طور، وليس فقط مخطط الطور البسيط المكون من مكون واحد فقط الذي وصفته. تساعد قاعدة الطور الكيميائي على تفسير المخططات واستخلاص استنتاجات حول تراكيب المخاليط، وفي ذلك التركيب المتغير للسوائل مثل البترول، أثناء تقطيرها وتنقيتها. وتُعد مخططات الطور للأنواع الأكثر تعقيدًا ضرورية في علم المعادن وعلم السبائك، حيث تلخص تكوين المعادن والسبائك
تعليق
حتى تكتمل الفكرة تنص قاعدة الطور على ما يلي: F = C – P + 2؛ حيث F هو عدد المتغيرات الخارجية (مثل الضغط ودرجة الحرارة التي يمكن تغييرها، وC هو عدد المكونات، وP هو عدد الأطوار.
 الاكثر قراءة في الفيزياء الكيميائية
الاكثر قراءة في الفيزياء الكيميائية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















