


 النبات
النبات
 الحيوان
الحيوان
 الأحياء المجهرية
الأحياء المجهرية
 علم الأمراض
علم الأمراض
 التقانة الإحيائية
التقانة الإحيائية
 التقنية الحيوية المكروبية
التقنية الحيوية المكروبية
 التقنية الحياتية النانوية
التقنية الحياتية النانوية
 علم الأجنة
علم الأجنة
 الأحياء الجزيئي
الأحياء الجزيئي
 علم وظائف الأعضاء
علم وظائف الأعضاء
 الغدد
الغدد
 المضادات الحيوية
المضادات الحيوية|
أقرأ أيضاً
التاريخ: 19-2-2016
التاريخ: 2025-01-22
التاريخ: 2025-01-29
التاريخ: 2025-01-28
|
الجينات المثبطة للورم (مضادات الورم Anti-oncogene) هي جينات تحمي الخلية من السرطان. لكن في حالة تضررها أو تثبطيها قد تتحول الخلية إلى سرطانية، فهي تشفر بروتيناً له دور في التحكم بالنمو الخلوي. إن فقدان وظيفة الجينات المثبطة للورم أكثر أهمية في تكوين أنواع عديدة من السرطانات البشرية من تنشيط الجينات الورمية الابتدائية Proto-oncogene . (Weinberg, 2014)
p53 gene
جين p53 من الجينات المثبطة للورم Tumor suppressor genes في الإنسان ويقع في 17p13.1 (1984Matlashewski et al., ) يشفر بوساطة المورثة TP53، ويشفر جين p53 لبروتين نووي ينظم دورة الخلية، وقد وصف هذا الجين على أنه حارس أو حامي الجينوم فهو مسؤول عن إنتاج بروتين يحفز على قتل الخلايا التي تحتوي على DNA متضرر لمنعها من التحول إلى خلايا سرطانية، إذ أنه يعمل بثلاث آليات لمكافحة الورم وهي: توقف انقسام الخلية واصلاح الحامض النووي المتضرر وأخيراً موت الخلية المبرمج Apoptosis. فعند إصابة الحامض النووي بضرر، يعمل بروتين p53 على إيقاف نمو الخلية وذلك بإيقاف دورة الخلية في مرحلة النمو G1، ثم التعرف على الضرر بعدها يتم تنشيط بروتينات اصلاح الحامض النووي أو بالموت المبرمج للخلية إذا ثبت أنه ضرر لا يمكن اصلاحه (2009 ,Gilbert)
يعد تثبيط p53 واحداً من أهم التشوهات الوراثية في سرطان الرئة بحذف الزيجات غير المتماثلة (هجين) Hemizygous من الكرموسوم الذي يحتوي على جين p53، والذي يحدث في %90 من سرطان الرئة صغير الخلية SCLC وحوالي 65 % من سرطان الرئة غير صغير الخلية NSCLC Mogi et al., Demirhan et al., 2010; Wistuba et al., 2000) 2011 ; 2018 ,.Bailey et al)،وأثبتت الدراسات حدوث طفرة في p53 في 85 من 188 مريضاً بسرطان الرئة الغدي ADC أي بنسبة 45% (2008 ,.Ding et al) وطفرات p53 ممكن أن يرتبط حدوثها مع طفراتEGFR و KRASKosaka et al., 2004)).
PTEN gene
يقع جين Phosphatase and tensin homology) PTEN) في 10q23.31، وهو من الجينات المثبطة للورم Tumor suppressor gene إذ إنه يصنع انزيماً موجوداً في أغلب أنسجة الجسم تقريباً، يعمل كمثبط للورم لأنه يعمل على تنظيم انقسام الخلية وذلك بمنعها من النمو والانقسام بسرعة، يقوم أيضاً هذا الانزيم بفسفرة الدهون في غشاء البلازما ومن ثم يمنع إشارات النمو والتكاثر، وتشير الدلائل إلى أن هذا الانزيم يساعد أيضاً في حركة الخلية (الهجرة) والالتصاق (التصاق الخلايا بخلايا الأنسجة المحيطة)، وتكوين أوعية دموية جديدة Angiogenesis، فضلاً عن ذلك من المحتمل أن يؤدي دوراً في الحفاظ على استقرار المعلومات الوراثية للخلية. وكل هذه الوظائف تعني أنه يساعد في منع النمو غير المنضبط للخلايا الذي يؤدي إلى تكوين الأورام (2007 ,Baker). وفي دراسة أجرتها (2016 .Mahood et al) وجدت ان لهذا الجين علاقة بالإصابة بسرطان القولون والمستقيم Colorectal لدى المرضى من العراقيين وباستعمال طرائق التحليل الوراثي الجزيئية، ونادراً ما تحدث طفرات PTEN في حوالي %5 من NSCLC Jin et al., 2010)) كونها أكثر شيوعاً في SCC من ADC ( 10.2% مقابل 1.7% )وهو يرتبط بتاريخ التدخين .على النقيض من ذلك وجد انخفاض في تعبير البروتين في حوالي 75% من NSCLC Marsit et al., 2005)).
ERCC2/ XPD gene
يقع جين XPD xeroderma pigmentosum group D /Excision Repair Cross Complementing group 2)) على الذراع الطويل للكروموسوم 19q13.32)19) (الشكل 1) ويحتوي على 23 إكسون ويشفر هذا الجين لبروتين يبلغ طوله KD15تقريباً، ، يشفر لبروتين يتكون من 761 حامض أميني (1990 .Weber et al) و Adenosine triphosphate dependent 5'-3' DNA helicase activity وهو جزء رئيس في مجموعة البروتينات المعروفة بمعقد عامل النسخ ( Transcription Factor IIH (TFIIH) inkler et al.,1998 )W ) ومعقد عامل النسخ له وظيفتين أساسيتين، فهو يسهم في عملية نسخ الجين، ويساعد في اصلاح الحامض النووي المتضرر من الأشعة فوق البنفسجية، المواد الكيميائية السامة، الاشعاع، و الجزيئات غير المستقرة (الجذور الحرة)( 2001,Lehman).
إحدى الآليات الرئيسة التي تستعملها الخلايا في اصلاح DNA المتضرر هي اصلاح بالقص (Nucleotide Excision Repair (NER) ، ناسخ الجين XPD له دور في هذه الآلية وذلك بعمله Helicase إذ أنه يرتبط بمناطق معينة من سلسلتي الحلزون المزدوج للحامض النووي ويخفف الارتباط مؤقتاً (2006 ,.et al Hu) عندها تقوم بروتينات أخرى برفع الجزء غير الطبيعي وتحل محل المنطقة المتضررة بالحامض النووي الصحيح (Schaeffer et al 1994). يساهم أيضاً في بدء النسخ وفي السيطرة على دورة الخلــية والموت المبرمج.(Chen et al., 2003 ; Benhamous and Serasin, 2002)
يمكن أن تؤدي الطفرات في جين XPD إلى ظهور ثلاثة أنماط ظاهرية وسريرية وهيXeroderma Pigmintosum group D (XPD) ،الحثل الكبريتي الشعري (Trichothiodystrophy (TTD و XP مع متلازمة كوكايين
Cockayne syndrome ( Taylor et al., 1997).والأشكال المتعددة لهذا الجين يمكن أن تغير قدرة الاصلاح ومن ثم تؤثر في قابلية الإصابة بسرطان الرئة (2004 ,.Zhan et al., 2010 Hu et al).
دراسات عديدة وجدت ان النمطين Lys751 GIn و Asp312Asn غالباً ما يرتبطان بسرطان الرئة في المدخنين، وأفادت الدراسات أن الاليلات المتغيرة في Lys751GIn و Asp312Asn إرتبطت مع انخفاض قدرة اصلاح الحامض النووي عند قياسها مع adducts الحامض النووي (2010 ,.Matullo et al., 2001; Zhan et al)، إذ ان في الشكل Lys751Gin يستبدل الحامض الأميني القطبي (GIn) في الكودون (CAG(C allele بالحامض الأميني الأساسي (Lys) في الكودون AAG (A allele) (Butkiewicz et al., 2001) لذا فإن تعدد الأشكال في هذا الجين يغير بنية C الطرفية (C-terminal)، وهذا بدوره يؤدي إلى تغيير وظيفة بروتين XPD ومن ثم زيادة خطر الإصابة بسرطان الرئة (2009 ,.Monaco et al).
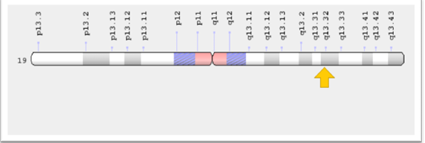
شكل (1) موقع الجين XPD على الكروموسوم 19 في الانسان ( ( https://ghr.nlm.nih.gov
FOXP3 gene
يقع Forkhead box P3) FOXP3) في الإنسان على الذراع القصير لكرموسوم X (X p11.23) (الشكل2) حجمه 1296bp، ويتكون من 12 إكسوناً، ويشفر لبروتين يتكون من431 حامضاً أمينياً، وهو عامل نسخ أساسي في خلايا Cell(CD4+CD25+regulatory T (Treg Torgerson et al., 2007 Lopes et al., 2006; Hori et al., 2003) ;2008 ,.Gambineri et al)
يعمل أيضاً كمنظم رئيس لتكوين ووظيفة الخلايا التائية التنظيمية Treg cells التي تؤدي دوراً مهماً في تثبيط المناعة الذاتية (2015 ,.Josefowicz et al ; 2012 ,.Saxena et al). ففي عام 2001 تم تحديد جين FOXP3 في الإنسان وفي فئران Scurfy كونه الجين المسؤول عن بعض أمراض المناعة الذاتية (2001 ,.Brunkow et al) وتؤدي الطفرات في هذا الجين إلى تثبيط الوظيفة التنظيمية لخلايا Treg Okumura et al., 2008 )) فضلاً عن ذلك تم توثيق جين FOXP3 كجين مثبط للورم Tumor suppressor gene (Kotoh et al. 2011 ; Martin et al., 2010) ، وحتى الآن تم وصف 13 من التعدد الشكلي للنيوكليوتيدات المفردة Single nucleotide polymorphisms (SNPs) في هذا الجين من بينها rs3761548, rs2294021, rs2232365, rs3761547، rs5902434 وموقعها في منطقة البروموتر من الجين (2018 ,.Zhang et al).
وأظهر تعدد الأشكال لهذا الجين ارتباطه بأمراض متعددة ومنها مرض جريفز disease Grave's Zheng et al., 2015 ; Bossowski et al., 2014))، التهاب المفاصل الروماتويدي Rheumatoid arthritisParadowska et al., 2015))، التصلب المتعدد Multiple sclerosis (Aljawadi et al., 2017 ( التهاب الأنف التحسسي Allergic rhinitis( Zhang, et al., 2012) ،الذئبة الحمراء Systemic lupus erythematosus (Lin et al.,2011) ومرض السكري من النوع الأول Type 1 diabetes ((Bjornvold. et al.,2006 .
وبالمقابل أظهرت بعض الدراسات أن جين FOXP3 قد تعطل في مجموعة من الخلايا السرطانية كما في عدة سرطانات مثل سرطان الرئة (2012 ,.He and Yong, 2013 : Shigematsu et al) الثدي (2010 ,.Han et al 2014 ,Lopes et al) البنكرياس (2007 ,.Hinz et al) الكبد ( ; 2018,.Chen et al 2013 ,.Talaat et al) القولون - المستقيم ( 2007 ,.Chen et al., 2014 : Ling et al) المبيض (2010 ,Zhang and Sun) و الجلد (2008 ,.Ebert et al).
أشارت الدراسات إلى وجود تمثيل مفرط وتغير في أعداد الخلايا التائية التنظيمية (Treg) سيما تلك التي يعبر عنها جين FOXP3 في الدم المحيطي لمرض الأورام الصلبة مقارنة مع الأشخاص السليمين (2001 ,.Beyer et al., 2006 ; Woo et al). لذا فإن جين FOXP3 يعد بمثابة علامة تشخيصية لاكتشاف خلايا (Treg) في الجسم (2018 .Zhang et al) فهو يسهم في تحويل الخلايا التائية غير المتخصصة (Native) إلى خلايا Treg مع النشاط الكابت (2015 ,.Saxena et al) يتم التعبير عن FOXP3 ليس فقط في خلايا T التنظيمية ولكن أيضاً في الخلايا الظهارية لمختلف الأعضاء كما في الرئة، الثدي، الغدة الصعترية، البروستات (2008 ,.Chen et al ) ،الدراسات التي تجمع بين جين FOXP3 وسرطان الرئة في جميع أنحاء العالم قليلة جداً، وفي العراق أجريت دراسة واحدة من قبل (2017,Al-Mugdadi et al). التي أشارت إلى أن FOXP3 يعد علامة مناعية ذات تطبيقات محتملة كعلامات تشخيصية في سرطان الرئة.

الشكل (2) موقع الجين FOXP3 على الكروموسوم Xفي الانسان
المصادر References
--------------------------------------------------------------------------------------------------------------
Aljawadi, Z. A.; Almahdawi, A. M.; Kashmoola, M. A. N. and Abdul Majeed, B. A. (2017). Forkhead box P3 gene expression and chromosomal in a sample of Iraqi patients with multiple sclerosis. J. Fac. Med. Baghdad., 59(1): 98-104.
Al-Mugdadi, S. F. H.; Hussen, W. M. and Ali, M. N. (2017). Immunohistochemical estimation of FOXP3 expression in Treg and cancer cell in Iraqi lung cancer tissue. Int. J. Adv. Res., 5(8): 87-95.
Bailey, M. H.; Tokheim, C.; Porta-Pardo, E.; Sengupta, S.; Bertrand, D.; Weerasinghe, A. and et al. (2018). Comperhansive charactirization of cancer driver genes and mutation. Cell., 173(2): 371-385. e18.
Baker, S. J. (2007). PTEN Enters the nuclear age. Cell., 128(1): 25-28.
Benhamous, S. and Sarasin, A. (2002). ERCC2/XPD gene polymorphisms and cancer risk. Mutagenesis. 17(16): 463-469.
Beyer, M. and Schulze, J. (2006). Regulatory T cells in cancer. Blood., 108(3): 804-811.
Bjornvold, M.; Amundsen, S. S.; Stene, L. C. (2006). FOXP3 polymorphisms in type 1 diabetes and coeliac disese. J. Autoimmun., 27(2): 140-144.
Bossowski, A.; Borysewicz-Sanczyk, H.; Wawrusiewicz-Kurylonek, N.; Zasim, A.;Szalecki, M.; Wikiera, B. and et al. (2014). Analysis of chosen polymorphisms in FOXP3 gene in chidrenand adolescents with autommune thyroid disease. Autoimmunity., 47(6):395-400.
Brunkow, M. E.; Jeffery, E. W.; Hjerrild, K. A.; Paeper, B.; Clark, L. B.; Yasayko, S. A.; Wilkinson, J. E.; Galas, D.; Ziegler, S. F. and Ramsdell, F. (2001). Disruption of a new forkhead/ winged-helix protein scurfin, results in the fatal lympoproliferative disorder of scurfy mouse. Nat. Genet., 27(1): 68-73.
Butkiewiez, D.; Rusin, M.; Enewold, L.; Sheilds, P. G.; Chorazy, M.; Harris, C. C. (2001). Genetic polymorphisms in DNA repair genes and risk of lung cancer. Carcinogenesis., 22(4): 593-597.
Chen, G. Y.; Chen, C.; Wang, L.; Chang, X.; Zheng, P. and Liu, Y. (2008). Broad expression of the FOXP3 locus in epithelial vells: A caution against an early interpretation of fotal inflammatory disease following in Vivo depletion of FOXP3-expressing cells. J. Immunol., 180(8): 5163-5166.
Chen, J.; Larochelle, S.; Li, X. and Sture, B. (2003). XPD/ERCC2 regulates CAK activity and mitotic progression. J. Nature., 424(6945): 228-232.
Chen, L.; Yu, Q.; Liu, B. and Zhu, L. (2014). Association of FOXP3 rs3761548 polymorphism with susceptibility to colorectal cancer in the Chinese population. Med. Oncol., 31(12): 374.
Chen, Y.; Zhang, H.; Liao, W.; Zhou, J.; He, G.; Xie, X.; Fei, R.; Qin, L.; Wei, L.; Chen, H. (2013). FOXP3 polymorphism is associated with hepatitis B-related hepatocellular carcinoma in China. J. Exp. Clin. Cancer. Res., 32: 39. 1-7.
Demirhan, O.; Tastemir, D.; Hasturk, S.; Kuleci, S. and Hanta, I. (2010). Alterations in P16 and P53 genes and chromosomal findings in patients with lung cancer. Fluorecence in situ hybridization and cytogenetic studies. Cancer. Epidemiol., 34(4): 472-477.
Ding, L.; Getz, G.; Wheeler, D. A.; Mardis, E. R.; Mclellan, M. D.; Cibulskis, K.; Sougnez, C.; Greulich, H.; Muzny, D. M.; Morgan, M. B. (2008). Somatic mutations affect key pathways in lung adenocarcinoma. Nature., 455: 1069-1075.
Ebert, L. M.; Tan, B. S.; Browning, J.; Svobodova, S.; Russell, S. (2008). The regulatory T cell. Associated transcription factor FOXP3 is expressed by tumor cells. Cancer. Res., 68(8): 3001-3009.
Gambineri, E.; Perroni, L.; Passerini, L.; Doglioni, C. and et al. (2008). Clinical and molecular profile of a new series of patients with immune dysregulation, polyendocrinopathy, enteropathy, X-linked syndrome: Inconsistent correlation between forkhead box protein 3 expression and disease sevetity. J. Allergy. Clin. Immunol., 122(6): 1055-1112.
Gilbert, S. F. (2009). Developmental biology, 10th ed. Sunderland, MA USA: Sinauer Associates, Inc. Publishers: 588 pp.
Han, X.; Bao, G. and Zhou, Y. (2010). FOXP3 rs22940 21 polymorphism contribites to the susceptibility to breast carcinoma. Chinese German. J. Clin. Oncology., 9(5): 253-257.
He, Y. Q. and Yong, W. (2013). FOXP3 genetic variants and risk of non small cell lung cancer in the Chinese Han population. Gene., 531(2): 422-425.
Hinz, S.; Pagerols-Raluy, L.; Oberg, H. H. (2007). FOXP3 expression in pancreatic carcinoma cells as novel mechanism of immune evasion in cancer. Cancer. Res., 67(17): 8344-8350.
Hori, S.; Nomura, T. and Sakaguchi, S. (2003). Control of regulatory T cell development by the transcription factor FOXP3. Sci., 299(5609): 1057-1061.
Hu, Z.; Wei, Q.; Wang, X. and Shen, H. (2004). DNA repair gene XPD polymorphism and lung cancer risk: ameta-analysis. Lung cancer., 46(1): 1-10.
Hu, Z.; Xu, L.; Shao, M.; Yuan, J.; Wang, Y.; Wang, F. and et al. (2006). Polymorphismsin the two helicases ERCC2 and ERCC2/XPB of the transcription factor 11 H complex and risk of lung cancer: a case-control analysis in a Chinese population. Cancer. Epidemiol Biomarkers. Prev., 15(7): 1336-1340.
Jin, G.; Kim, M. J.; Jeon, H. S.; Cho, J. E.; Kim, D. S.; Lee, E. B.; Cha, S. I.; Yoon, G. S.; Kim, C. H.; Jung, T. H. and Park, J. Y. (2010). PTEN mutations and relationship to EGFR, ERBB2, KRAS, and TP53 mutation in non-small cell lung cancer. Lung cancer., 69(3):279-283.
Josefowicz, S. Z.; Lu, L- F. and Rudensky, A. Y. (2012). Regulatory T cells: mechanisms of differentiation and function. Annu. Rev. Immunol., 30: 531-564.
Katoh, H.; Zheng, P. and Liu, Y. (2011). Signalling through FOXP3 as an X-linked tumor suppressor. Int. J. Biochem. Cell. Biol., 42(11): 1784-1787.
Kosaka, T.; Yatabe, Y.; Endoh, H.; Kuwano, H.; Takahshi, T. and Mitsudomi, T. (2004). Mutation of the Epidermal Growth Factor Receptor Gene in Lung Cancer: Biological and Clinical Implacations. Cancer. Res., 64(24): 8919-23.
Lehmann, A. R. (2001). The xeroderma pigmintosum group D (XPD) gene :one gene, tow function, three diseases. Gene Dev.15(1):15-23
Lin, Y. C.; Lee, J. H.; Wu, A. S. H; Tsai, C. Y.; Yu, H. H.; Wang, L. C.; Yang, Y. H.; Chiang, B. L. (2011). Association of single- nucleotide polymorphisms in FOXP3 gene with systemic lupus erythematosus susceptibility: a case- control study. Lupus., 20(2): 137-143.
Ling, K. L.; Pratap, S. E.; Bates, G. J.; Singh, B.; Mortensen, N. J.; George, B. D.; Warren, B. F.; Piris, J.; Roncador, G.; Fox, S. B.; Bnham, A.H.; Cerundoio, V. (2007). Increased frequency of regulatory T cell in peripheral blood and tumor infilterating lymphocytes in colorectal cancer patients. Cancer. Immun., 7(1): 1-7.
Lopes, J. E.; Torgerson, T. R.; Schubert, L. A.; Anover, S. D.; Ocheltree, E. L.; Ochs, H. D. and Ziegler, S. F. (2006). Analysis of FOXP3 Reveals Multiple Domains Required for Its Function as a Transcriptional Repressor. J. Immunol., 177(5): 3133-3142.
Lopes, L. B.; Baleotti, W. Jr.; Suzuki, R. B.; Fabron, A. Jr.;Chiba, A. K.; Vieira-Filho, J. P. de Souza Castro, B.; Midori Kunioshi, A. and Bordin, J. O. (2014). HNA-3 gene frequencies in Brazilians and a new polymerase chain reaction-restriction fragment length polymorphism method for HNA-3a/3b genotyping. Transfusion., 54(6): 1619-1621.
Mahood, W. S.; Al-Musawi, I. H. N and Jawad, M. M. (2016). Molecular analysis of PTEN gene in some Iraqi colorectal cancer patients. AJBM., 4(7): 191-198.
Marsit, C. J.; Zheng, S.; Aldape, K.; Hinds, P. W.; Nelson, H. H.; Wiencke, J. K. and Kelsey, K. T. (2005). PTEN expression in non small-cell lung cancer:evaluating its relation to tumor characteristics, allelic loss, and epigenetic alteration. Hum. Pathol., 36(7): 768-776.
Matlashewski, G.; Lamb, P.; Pim, D.; Peacock, J.; Crawford, L. and Benchimol, S. (1984). Isolation and characterization of a human P53 cDNA clone: expression of the human P53 gene. The EMBO Journal., 3:(13) 3257-3262.
Matullo, G.; Palli, D.; Peluso, M.; Guarrera, S.; Carturan, S.; Celentano, E.; Krogh, V.; Munnia, A.; Tumino, R.; Polidoro, S.; Piazza, A. and Vineis, P. (2001). XRCC1, XRCC3, XPD gene polymorphisms, smoking and (32)P-DNA adducts in a sample of healthy subjects. Carcinogenesis., 22(9): 1437-1445.
Mogi, A. and Kuwano, H. (2011). TP53 mutations in non-small cell lung cancer. J. Biomed. Biotechnol., 583929: 1-9.
Monaco, R.; Rsal, R.; Dolan, M. A.; Pincus, M.R.; Freyer, G.; Brandt Rauf, P. W. (2009). Conformational effects of a common codon 751 polymorphism on c-terminal domain of xeroderma pigmentosum D protein. J Carcinog., 8: 12.
Okumura, A.; Ishikawa, T.; Sato, S.; Yamauchi, T.; Oshima, H.; Ohashi, K.; Sato, K.; Ayada, M.; Hotta, N. and Kakumu, S. (2008). Deficiency of forkhead box P3 and cytotoxic T-lymphocyte associated antigen-4 gene expressions and impaired suppressor function of CD4(+)CD25(+) T cells in patients with autoimmune hepatitis. Hepatol. Res., 38(9): 896-803.
Paradowska-Gorycka, A.; Jurkowska, M.; Felis-Giemza, Prochnicka Pomanowska, Manczak, M.; Maslinski, S. and Olesinska, M. (2015). Genetic polymorphisms of FOXP3 in patients with Rheumatoid Arthritis. J. Rheumatol., 42(2): 170-180.
Saxena, D.; Misra, M. K.; Parveen, F.; Phadke, S. R.; Agrawal, S. (2015). The transcription factor Forkhead Box P3 gene variants affect idiopathic recurrent pregnancy loss. Placenta., 36(2): 226-231.
Schaeffer, L.; Moncollin, V.; Roy, R.; Staub, A.; Mezzina, M.; Sarasin, A.; Weeda, G.; Hoeijmakers, J. H. J. and Egly, J. M. (1994). The ERCC2/DNA repair protien is associated with the class 11BTF2/TF11H transcription factor. J. The EMBO., 13(10): 2388 2392.
Shigematsu, Y.; Hanagiri, T.; Shiota, H.; Kuroda, K.; Baba, T.; Ichiki,Y.; Yasuda, M.;Uramoto, H.; Takenoyama, M.; Yasumoto, K. and Tanaka, F. (2012). Immunosuppressive effect of regulatory T lymhphosytes in lung cancer, with special reference to their effects on the induction of autologous tumor-specific cytotoxic T lymphocytes. Oncol. Lett., 4(4): 625-630.
Talaat, R. M.; Seada, S. M.; Mohamed, G. I.; Abdel-Moez, A. T. and Mokhles, M. (2018).Polymorphism of FOXP3 in Egyptian patients with hepatocellular carcinoma (HCC). EC.CRONICON., 97-106.
Taylor, E. M.; Broughton, B. C.; Botta, E.; Stefanini, M.; Sarasin, A.; Jaspers, N. G. J.; Fawcett, H.; Harcourt, S. A.; Arlett, C. F. and Lehmann, A. R. (1997). Xeroderma pigmintosum and trichothio- dystrophy are associated with different mutations in the XPD (ERCC2) repair/ transcription gene. Proc. Natl. Acad. Sci. USA., 94(16): 8658-8663.
Torgerson, T. R.; Linane, A.; Moes, N.; Anover, S.; Mateo, V.; Rieux Laucat, F.; Hermine, O.; Vijay, S.; Gambineri, E.; Cerf-Bensussan, N.; Fischer, A.; Ochs, H. D.; Goulet, O. and Ruemmele, F. M. (2007). Sever food allergy as a variant of IPEX syndrome caused by a deletion in a noncoding region of the FOXP3 gene. Gastroentology., 132(5): 1705-1717.
Weber, C. A.; Salazar, E. P.; Stewart, S. A. and Thompson, L. H. (1990). ERCC2: cDNA cloning and molecular characterization of human nucleotide excision repair gene with high homology to yeast RAD3. J. EMBO., 9(5): 1437-1447.
Weinberg, R. A. (2014). The biology of cancer. New York. 2nd ed. Garland. Sci., pp: 878.
Winkler, G. S.; Vermeulen, W.; Coin, F.; Egly, J.-M.; Hoeijmakers, J. H. G. and Weeda, G. (1998). Affinity Purification of Human DNA Repair/Transcription Factor TFIIH Using Epitope-tagged Xeroderma Pigmentosum B Protein. J. Biol. Chem., 273(2): 1092-
Wistube, I. I.; Berry, J.; Behrens, C.; Maitra, A.; Shivapurkar, N.; Milchgrub, S.; Mackay, B.; Minna, I. D. a Gazdar, A. F. (2000). Molecular changes in the bronchial epithelium of patients with small cell lung cancer. Clin. Cancer. Res., 6(7): 2604-2610.
Woo, E. Y.; Chu, C. S.; Goletz, T. J.; Schlienger, K.; Yeh, K.; Coukos, G.; Rubin, S. C.; Kaiser, L. R. and June, C. H. (2001). Regulatory CD4(+)CD25(+) T cells in tumors from patients with early-stage non-small cell lung cancer and late-stage ovarian cancer. cancer. Res., 61(12): 4766-4772.
Zhan, P.; Wang, Q.; Wei, S. Z.; Qian, Q.; Yu, L. K. and Song, Y. (2010). ERCC2/XPDLYS 751 Glan and Asp 312 Asn gene polymorphism and lung cancer risk: ameta-analysis involving 22 case-control studies. J. Thorac.Oncol., 5(9): 1337-1345.
Zhang, H-Y. and Sun, H. (2010). Up-regulation of FOXP3 inhibits cell proloferation, migration and invasion in epithelial ovarian cancer. Cancer. Letter., 287(1): 91-97.
Zhang, Y.; Duan, S.; Wei, X.; Zhao, L. and Zhang, L. (2012). Association between polymorphis in FOXP3 and EB13 genes and risk for development of allergic rhinitis in Chinese subjects. J. Hum Immunol., 73(9): 939-945.
Zhang, Y.; Xu, L.; Zhou, B.; Li, Q.; You, D.; Liu, C.; Song, H.; Wang, Y. Song, Y.; Su, M.; Huang, X.; Yuan, M.; Lan, Z. and Wang, W. (2018). Transcription factor FOXP3 gene variants affect epithelial ovarian carcinoma in the Han Chinese population. Int. J. Clin. Exp. Pathol., 11(3): 1684-1693.
Zhang, Y.; Xu, L.; Zhou, B.; Li, Q.; You, D.; Liu, C.; Song, H.; Wang, Y. Song, Y.; Su, M.; Huang, X.; Yuan, M.; Lan, Z. and Wang, W. (2018). Transcription factor FOXP3 gene variants affect epithelial ovarian carcinoma in the Han Chinese population. Int. J. Clin. Exp. Pathol., 11(3): 1684-1693.
Zheng, L.; Wang, X. B.; Xu, L.; Wang, N.; Cai, P.; Liang, T.and Hu, L. (2015). FOXP3 gene polymorphisms and haplotypes associate with susceptibility of graves disease in Chinese Han population. Int. Immunopharmacol., 25(2): 431-425.

|
|
|
|
للعاملين في الليل.. حيلة صحية تجنبكم خطر هذا النوع من العمل
|
|
|
|
|
|
|
"ناسا" تحتفي برائد الفضاء السوفياتي يوري غاغارين
|
|
|
|
|
|
|
نحو شراكة وطنية متكاملة.. الأمين العام للعتبة الحسينية يبحث مع وكيل وزارة الخارجية آفاق التعاون المؤسسي
|
|
|