
تاريخ الفيزياء

علماء الفيزياء


الفيزياء الكلاسيكية

الميكانيك

الديناميكا الحرارية


الكهربائية والمغناطيسية

الكهربائية

المغناطيسية

الكهرومغناطيسية


علم البصريات

تاريخ علم البصريات

الضوء

مواضيع عامة في علم البصريات

الصوت


الفيزياء الحديثة


النظرية النسبية

النظرية النسبية الخاصة

النظرية النسبية العامة

مواضيع عامة في النظرية النسبية

ميكانيكا الكم

الفيزياء الذرية

الفيزياء الجزيئية


الفيزياء النووية

مواضيع عامة في الفيزياء النووية

النشاط الاشعاعي


فيزياء الحالة الصلبة

الموصلات

أشباه الموصلات

العوازل

مواضيع عامة في الفيزياء الصلبة

فيزياء الجوامد


الليزر

أنواع الليزر

بعض تطبيقات الليزر

مواضيع عامة في الليزر


علم الفلك

تاريخ وعلماء علم الفلك

الثقوب السوداء


المجموعة الشمسية

الشمس

كوكب عطارد

كوكب الزهرة

كوكب الأرض

كوكب المريخ

كوكب المشتري

كوكب زحل

كوكب أورانوس

كوكب نبتون

كوكب بلوتو

القمر

كواكب ومواضيع اخرى

مواضيع عامة في علم الفلك

النجوم

البلازما

الألكترونيات

خواص المادة


الطاقة البديلة

الطاقة الشمسية

مواضيع عامة في الطاقة البديلة

المد والجزر

فيزياء الجسيمات


الفيزياء والعلوم الأخرى

الفيزياء الكيميائية

الفيزياء الرياضية

الفيزياء الحيوية

الفيزياء والفلسفة

الفيزياء العامة


مواضيع عامة في الفيزياء

تجارب فيزيائية

مصطلحات وتعاريف فيزيائية

وحدات القياس الفيزيائية

طرائف الفيزياء

مواضيع اخرى
الرابطة التساهمية (Covalent Bond)
المؤلف:
أ.د. محمود محمد سليم صالح
المصدر:
تقنية النانو وعصر علمي جديد
الجزء والصفحة:
ص27–28
2023-07-22
4568
ترجع فكرة الترابط التساهمي إلى جيلبرت لويس الذي وصف في عام 1916 م مساهمة أزواج الإلكترونات بين الذرات. وقد اقترح ما يسمى بناء لويس، أو الشكل الإلكتروني النقطي الذي تكون فيه إلكترونات التكافؤ (الموجودة في غلاف التكافؤ)، وهي ممثلة بنقط حول الرمز الذري، وتكون أزواج الإلكترونات الموجودة بين الذرات ممثلة للروابط التساهمية. كما أن الأزواج بكثرتها تمثل روابط كثيرة، مثل: الرابطة الثنائية أو الثلاثية. وهناك طريقة أخرى لتمثيل الرابطة، وتكمن في تمثيلها خطوطاً موضحة باللون الأزرق. في حين أنّ فكرة تمثيل أزواج الإلكترونات تعطي طريقة مؤثرة؛ لتصور الرابطة التساهمية؛ لأن دراسات ميكانيكا الكم تحتاج إلى فهم طبيعة تلك الرابطة، وتوقع تركيب وخواص الجزيئات البسيطة. وقد قدّم والتر هتلر وفريتز لندن أول توضيح ناجح من وجهة نظر ميكانيكا الكم للترابط الكيميائي، وخاصة للهيدروجين الجزيئي، وذلك في عام 1927 م. وقد كان عملهما مبنيا على أساس تصور رابطة التكافؤ، حيث افترضا أنّ الرابطة الكيميائية تتكوّن عند وجود تداخل جيد بين المدارات الذرية للذرات المساهمة. وتكون بين هذه المدارات الذرية زاوية محددة. كما تكون هذه الرابطة في الغالب بين غير الفلزات فقط.
والرابطة التساهمية هي أحد أشكال الترابط الكيميائي، وتتميز بمساهمة زوج أو أكثر من الإلكترونات بين الذرات؛ مما ينتج عن ذلك تجاذب جانبي يعمل على تماسك الجزيء الناتج. وتميل الذرات إلى المساهمة، أو المشاركة بإلكتروناتها بالطريقة التي تجعل غلافها الإلكتروني ممتلئا. وهذه الرابطة دائما أقوى من القوى التي بين الجزيئات، كما أنها تشبه الرابطة الأيونية في القوة، وتكون أحيانًا أقوى منها. وتحدث الرابطة التساهمية في الغالب بين الذرات التي لها سالبية كهربية عالية؛ لأن ذلك يستلزم طاقة كبيرة؛ لتحريك إلكترون من الذرة والرابطة التساهمية تحدث في الغالب بين غير الفلزات، حيث تكون الرابطة الأيونية أكثر شيوعًا بين الذرات الفلزية. وبعكس الرابطة الأيونية، حيث ترتبط الأيونات بقوى كهروستاتيكية (Electrostatics) غير موجهة، وتكون الرابطة التساهمية حينها عالية التوجيه. وينتج عن ذلك ميل الجزيئات المرتبطة تساهميًّا إلى التكوّن في هيئة أشكال مميزة قليلة نسبيا، وبزوايا محددة.
التساهمية القطبية
وتحدث عندما تكون الرابطة التساهمية بين ذرتين مختلفتين في السالبية الكهربائية؛ لأنّ الزوج يكون منجذبًا أكثر إلى الذرة ذات السالبية الكهربائية العليا، ومن ثم تظهر شحنة سالبة جزئية على هذه الذرة وشحنة موجبة جزئية على الذرة ذات السالبية الدنيا وهذه الرابطة تشارك فيها الإلكترونات مشاركة غير متساوية. ومن الأمثلة المشهورة على هذه الرابطة تلك التي تحدث بين الأكسجين والهيدروجين.
التساهمية غير القطبية
إذا كانت الذرتان متساويتان أو متقاربتان في السالبية فإنّ الرابطة تكون تساهمية غير قطبية، مثل: 2H، Cl، وفي هذه الحالة لا تعتمد قطبية المركب على الرابطة ، بل تعتمد على العزوم الكهربائي. وهذه الرابطة تنشأ بين ذرات العنصر نفسه، وتمثل ذلك الرابطة غير القطبية الثلاثية التي تنشأ بين ذرات النيتروجين في جزيء النيتروجين.
الرابطة التساهمية التناسقية
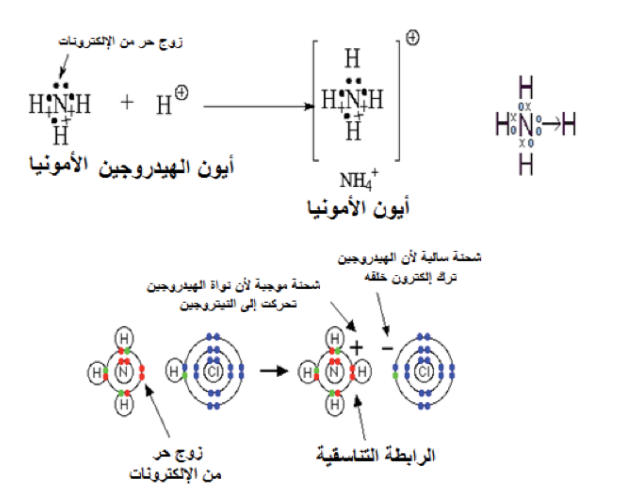
تتم بين ذرتين إحداهما تحتوي على زوج أو أكثر من الإلكترونات الحرة، والثانية تلزمها هذه الإلكترونات؛ للوصول إلى حالة الاستقرار، فالزوج الإلكتروني هنا لا تسهم فيه الذرتان، وإنما تسهم فيه إحداهما فقط، مثل: تفاعل النشادر مع كلوريد الهيدروجين؛ لإنتاج ملح كلوريد الأمونيوم، حيث تتكون رابطة تناسقية بين ذرة النيتروجين في النشادر وذرة الهيدروجين في كلوريد الهيدروجين. بمعنى أن الرابطة التناسقية تتكوّن بين ذرة مانحة، تتكوّن عليها شحنة موجبة، وذرة مستقبلة، تتكون عليها شحنة سالبة. ويشار إلى الرابطة التناسقية في العادة بسهم يتجه من الذرة المانحة إلى الذرة المستقبلة (انظر: الشكل رقم 10). وحقيقة ما حدث في التفاعل السابق هو ارتباط جزيء النشادر بالبروتون؛ ليتكوّن أيون الأمونيوم.
شكل رقم 10 الرابطة التساهمية التناسقية؛ لإنتاج كلوريد الأمنيوم.
 الاكثر قراءة في الفيزياء الكيميائية
الاكثر قراءة في الفيزياء الكيميائية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















