
تاريخ الفيزياء

علماء الفيزياء


الفيزياء الكلاسيكية

الميكانيك

الديناميكا الحرارية


الكهربائية والمغناطيسية

الكهربائية

المغناطيسية

الكهرومغناطيسية


علم البصريات

تاريخ علم البصريات

الضوء

مواضيع عامة في علم البصريات

الصوت


الفيزياء الحديثة


النظرية النسبية

النظرية النسبية الخاصة

النظرية النسبية العامة

مواضيع عامة في النظرية النسبية

ميكانيكا الكم

الفيزياء الذرية

الفيزياء الجزيئية


الفيزياء النووية

مواضيع عامة في الفيزياء النووية

النشاط الاشعاعي


فيزياء الحالة الصلبة

الموصلات

أشباه الموصلات

العوازل

مواضيع عامة في الفيزياء الصلبة

فيزياء الجوامد


الليزر

أنواع الليزر

بعض تطبيقات الليزر

مواضيع عامة في الليزر


علم الفلك

تاريخ وعلماء علم الفلك

الثقوب السوداء


المجموعة الشمسية

الشمس

كوكب عطارد

كوكب الزهرة

كوكب الأرض

كوكب المريخ

كوكب المشتري

كوكب زحل

كوكب أورانوس

كوكب نبتون

كوكب بلوتو

القمر

كواكب ومواضيع اخرى

مواضيع عامة في علم الفلك

النجوم

البلازما

الألكترونيات

خواص المادة


الطاقة البديلة

الطاقة الشمسية

مواضيع عامة في الطاقة البديلة

المد والجزر

فيزياء الجسيمات


الفيزياء والعلوم الأخرى

الفيزياء الكيميائية

الفيزياء الرياضية

الفيزياء الحيوية

الفيزياء العامة


مواضيع عامة في الفيزياء

تجارب فيزيائية

مصطلحات وتعاريف فيزيائية

وحدات القياس الفيزيائية

طرائف الفيزياء

مواضيع اخرى
Molar Heat Capacity
المؤلف:
E. R. Huggins
المصدر:
Physics 2000
الجزء والصفحة:
489
9-12-2020
1709
Molar Heat Capacity
If, instead of measuring the heat capacity of a unit mass, we measure the heat capacity of a mole of a substance, we call the result the molar heat capacity. For example a water molecule H2O with 2 hydrogen and 1 oxygen atom is 18 times as massive as a hydrogen atom. Its molecular weight is 18, and thus a mole of water has a mass of 18 grams. As a result it takes 18 calories to raise the temperature of a mole of water 1 degree centigrade, and thus the molar heat capacity of water is 18 calories/ mole °C or 18 × 4.186 = 75.3 joules/mole °C. For the units, instead of degrees centigrade, we can use kelvins, which are the same size. Thus we can write
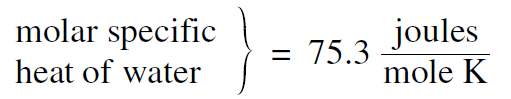 ......(1)
......(1)
as an example of a molar specific heat.
Predicting the specific heat of a substance, even with an understanding of the atomic and molecular processes involved, turned out to be a much more difficult subject than expected. The first time a failure of Newtonian mechanics was detected was during the efforts to predict the specific heats of various gases. This failure was due to quantum mechanics being necessary to fully understand what happened to the added heat energy.
There is one example, however, where the simple picture of atoms we have been discussing gives the correct answer. That is for the specific heat of helium gas. We will discuss that example here, an entire chapter devoted to the subject.