


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية | الذوبان : المواد المذابة اللاأيونية Solubility: non-ionic solutes |
|
|
|
أقرأ أيضاً
التاريخ: 27-9-2020
التاريخ: 18-10-2019
التاريخ: 31-12-2021
التاريخ: 28-10-2020
|
الذوبان : المواد المذابة اللاأيونية Solubility: non-ionic solutes
تتوقف خواص ذوبان المواد المذابة اللاأيونية ، كما راينا سابقاً ، بصورة رئيسية على قطيتها، وبخاصة على قدرتها على تشكيل روابط هيدروجينية ، ويعبر عن ذلك بعبارة الشبيه يحل شبيهه اعتماداً على التجربة.
لندرس انواع المركبات التي صادفناها سابقاً مبتدئين بالهيدروكربونات وهاليدات الألكيل. وهذه مركبات لا قطبية أو ضعيفة القطبية، وتنحل في مذيبات ذات قطبية مشابهة . فهي تنحل مثلاً في الهيدروكربونات مثل الليغروئين أو تمسك الجزيئات المذابة ببعضها وجزيئات المذيب ببعضها يحل محلها بسهولة قوى مماثلة تمسك الجزيئات المذابة إلى جزيئات المذيب. لا تنحل الهيدروكربونات وهاليدات الالكيل في الماء، الذي تكون جزيئاته عالية القطبية ، ومرتبطة ببعضها بقوة برابطة هيدروجينية.
دعنا نعود ثانية إلى الكحولات . راينا ان الكحولات من الناحية البنيوية مركبة من الألكان والماء، فهي تحتوي على زمرة الألكيل المشابهة للألكان وعلى زمرة الهيدروكسيل المشابهة للماء.

إن زمرة الهيدروكسيل قطبية تماماً، والأهم من ذلك أنها تحتوي على هيدروجين مرتبط إلى ذرة أكسجين عالية الكهرسلبية وعبر زمرة الهيدروكسيل تكون الكحولات على تشكيل روابط هيدروجينية فيما بينهما، الأمر الذي يميز الكحولات بنقاط غليان عالية بشكل غير عادي
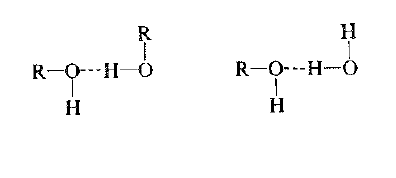
كما انها تكون قادرة على تشكيل روابط هيدروجينية مع جزيئات أخرى، مما يجعل الكحولات قادرة على الذوبان في المركبات الهيدروكسيلية الأخرى
رأينا سابقاً ان اول فرد من الكحولات وهو الميتانول (CH3OH) يذوب ذوباناً كاملاً في الماء . تحل الروابط الهيدروجينية بين جزيئات الماء والميتانول بسهولة محل الروابط الهيدروجينية بين جزيئات الميتانول المختلفة، وبين جزيئات الماء المختلفة.
والآن وبسبب الوضع الخاص المتميز للماء بوصفه مذيباً وبخاصة في المنظومات الحيوية، فإن مصطلحي محب للماء وكاره للماء يستعملان للدلالة على الذوبان في الماء او عدمه . وغالباً في الماء وعدم الذوبان في المذيبات اللاقطبية. وهكذا فإن الميتانول محب للماء، أما الالكانات وهاليدات الالكيل فإنها محبة للشحوم (أو كارهة للماء).
بما انه من الاسهل التعامل مع مصطلح يعبر عن حالة إيجابية اكثر من المصطلح الذي يعبر عن حالة سلبية، فسوف نستخدم في هذا الكتاب، عموماً، مصطلح محب للشحوم، ويقصد بهذا المصطلح ببساطة الإشارة إلى حقيقة الذوبان في المذيبات اللاقطبية. ربما يكون الأمر، كما هو معروف عموماً، هو ان الذوبان يعزى بصورة رئيسية إلى الرفض الذي يبديه الماء أكثر من القبول الإيجابي الذي يبديه المذيب اللاقطبي.
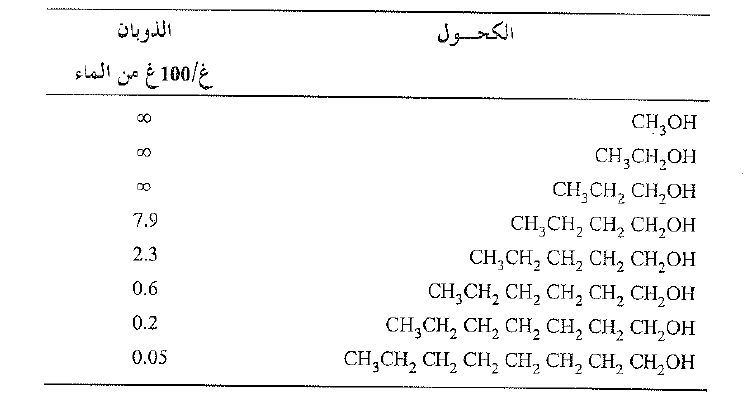
لندرس بعد ذلك سلسلة من الكحولات ، وتأثير زمرة الالكيل على الذوبان. حيث تكون زمرة الهيدروكسيل محبة للماء، وتكون الزمرة الالكيلية محبة للشحوم . يعطي الجدول 1.1 ذوبان سلسلة من الكحولات في الماء. ففي الكحولات الدنيا تشكل زمرة الهيدروكسيل –OH قسماً كبيراً من الجزيء وهذه المركبات قابلة للذوبان في الماء. ولكننا نرى انه مع ازدياد عدد ذرات الكربون يتناقص الذوبان بصورة حادة. تكون السلسلة الطويلة المحتوي على –OH عند احد طرفيها في معظمها هيدروكربونية، ويبين ذوبانها ذلك. (انظر الشكل 1.1).
الجدول 1.1 ذوبان الكحولات في الماء
الآن إذا كان الجزيء كبيراً بشكل كاف، وليكن كحول مثلاً تحتوي سلسلته على 20-16 ذرة كربونية أو اكثر، فإن الاجزاء المحبة للماء والمحبة للشحوم تظهر خواصها الذوبانية الفردية. تنحل الاجزاء المحبة للماء في الماء، وتنحل الاجزاء المحبة للشحوم في مذيب لا قطبي. وفي حالة عدم وجود اي منها فإنها تنعقد ، وفي الواقع فإنها تنحل في بعضها. يعطي مثل هذا السلوك من الذوبان المزدوج الصوابين والمنظفات قوتها في التنظيف. ويتحكم في تراصف الجزيئات وانتظامها في الأغشية الخلوية يلتف الجزيء البروتيني الكروي، وليكن الانزيم مثلاً، ليكشف أجزاءه المحبة للماء المحيط بها وليخفي أجزاءه المحبة للشحوم، وهو يكتسب خلال عمله هذا الشكل الخاص الذي تتطلبه خواصه الحيوية المميزة .

الشكل 1.1 : البنية الجزيئية والخواص الفيزيائية : الذوبان . (أ) الكحول المتيلي ، (ب) الكحول الاتيلي، (جـ) كحول نظامي البوتيلي ، و(د) كحول نظامي الاوكتيل. كلما ازداد حجم زمرة الالكيل اصبح الجزيء اكثر شبهاً. بالألكان وتناقص ذوبانه في الماء.


|
|
|
|
هل يمكن أن تكون الطماطم مفتاح الوقاية من السرطان؟
|
|
|
|
|
|
|
اكتشاف عرائس"غريبة" عمرها 2400 عام على قمة هرم بالسلفادور
|
|
|
|
|
|
|
جامعة الكفيل تقيم ندوة علمية عن الاعتماد الأكاديمي في جامعة جابر بن حيّان
|
|
|