


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 16-4-2017
التاريخ: 2024-02-04
التاريخ: 25-2-2018
التاريخ: 16-4-2017
|
يمكن القول بأن رقم الحموضة أو الأس الهيدروجيني أو ما يطلق عليه الـ pH ورقم القاعدية أو أس أيون الهيدروكسيل وهو ما يطرق عليه pOH ويعرف الـ pH بأنه اللوغاريتم السالب للتركيز المولاري لأيون الهيدروجين بالجم – أيون / لتر أو اللوغاريتم الموجب لمقلوب تركيز أيون الهيدروجين بالجم – أيون / لتر للأساس10 أي أن :
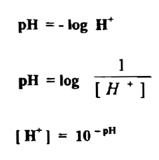
وباستخدام المعادلة الأولى فإن الرقم الهيدروجيني لمحلول يحوي 3- 10 مول في اللتر من أيونات الهيدروجين هو 3 ، وانه من السهل علينا استعمال الرقم 3 بدلاً من المقدار الأس أو الكسر 3- 10 طالما كان الرقم 3 يوضح المعنى نفسه . ولو أخذنا لوغاريتم الطرفين في المعادلة الأخيرة تتحول إلى صورة كما يأتي :

ويمكن التعبير بالطريقة نفسها عن تركيز أيون الهيدروكسيل برقم مشابه هو رقم القاعدية pOH إذ يساوي اللوغاريتم السالب لتركيز أيون الهيدروكسيل بالجم - أيون / لتر أو اللوغاريتم الموجب المقلوب تركيز أيون الهيدروكسيل بالجم – أيون / لتر ويمكن توضيح ذلك كما يأتي :

ونكتفي عادة في التعبير عن درجة الحموضة أو القاعدية للمحلول برقم pH ويمكن أن نستنج تركيز أيون الهيدروجين والهيدروكسيل بمعرفة تركيز أحدهما وذلك من :

ويتضح من هاتين المعادلتين انه بزيادة تركيز أيون الهيدروجين لمحلول ما يقل تركيز أيون الهيدروكسيل فيه والعكس صحيح بنقص تركيز أيون الهيدروجين يزيد تركيز أيون الهيدروكسيل وبأخذ اللوغاريتم السالب لكل من الطرفين في المعادلة الأساسية يتضح :

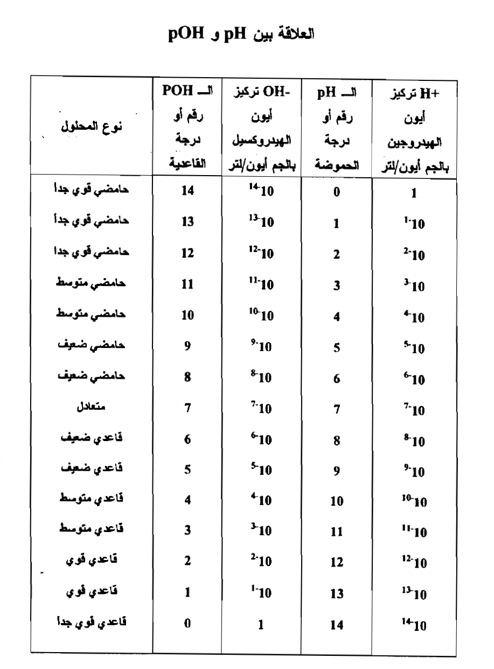
أي انه في أي محلول فإن مجموع رقمي الحموضة يساوي 14 ويمكن توضيح هذه العلاقة في جدول يبين جميع التراكيز من صفر إلي -14 10 لكل من أيون الهيدروجين وأيون الهيدروكسيل ، وكذلك توضح أرقام الـ pH والـ pOH من صفر إلى 14 المقابلة لكل تركيز يبين الجدول التالي العلاقة بين تركيز أيون الهيدروجين والـ pH وبين تركيز أيـــون الهيدروكسيل pOH .


|
|
|
|
التوتر والسرطان.. علماء يحذرون من "صلة خطيرة"
|
|
|
|
|
|
|
مرآة السيارة: مدى دقة عكسها للصورة الصحيحة
|
|
|
|
|
|
|
نحو شراكة وطنية متكاملة.. الأمين العام للعتبة الحسينية يبحث مع وكيل وزارة الخارجية آفاق التعاون المؤسسي
|
|
|