


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 2024-08-12
التاريخ: 2024-02-03
التاريخ: 18-4-2017
التاريخ: 2023-09-26
|
1- الترسيب :
يفيد حاصل الإذابة في تفاعلات الترسيب . فعندما تزيد قيمة حاصل ضرد الأسس المخصصة لتركيزات أي نوعين من الأيونات في المحلول عن قيمة حاصل الإذابة المناظر يترسب الأيون الموجب والأيون السالب نتيجة لأتحادهما حتى يصبح حاصل ضرب تركيز هذين النوعين من الأيونات المتبقية في المحلول ( مرفوعاً الـــى الأس المناسب له ) مساوياً لقيمة حاصل الإذابة
فمثلاً :
عندما يضاف بعض من فلوريد الصوديوم NaF الى محلول مشبع من فلوريد الكالسيوم 2CaF فإن [F -] تزيد كثيراً وبذلك يزداد قيمة حاصل ضرب درجة تركيز الأيونات زيادة مؤقتة عن قيمة حاصل الإذابة . وللمحافظة على حالة الاتزان يتحد بعض من مع كمية مكافئة من - F ليتكون CaF2 الصلب الى أن يصبح حاصل ضرب تركيزات الأيونات المتبقية في المحلول 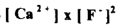 مساوياً مرة أخرى
مساوياً مرة أخرى
لحاصل الإذابة ويجب أن نلاحظ في هذه الحالة أن القيمة النهائية لتركيز أيون الفلوريد [F-] أكبر بكثير من ضعف قيمة [Ca +2 ] لأن فلوريد الصوديوم يساهم بكمية كبيرة من قيمة [F-] الكلية
2- ذوبان الرواسب :
حينما يكون حاصل ضرب تركيز أي أيونين ( مرفوعاً الي الأس المناسب ) فـــي محلول أقل من حاصل الإذابة المناظر ، فإن المحلول لا يكون مشبعاً وإذا أضيفت بعض من الأملاح الصلبة المناظرة الي المحلول فإن كمية أكبر من الملح تذوب . فمثلاً إذا أضيف حامض الهيدروكلوريك ( مصدر الحصول على+H ) الي محلول من هيدروكسيد المغنسيوم فإن أيون الهيدروجين +H يتفاعل تقريباً مع كل أيونات – OH لتكوين الماء حيث يقل بذلك تركيز أيونات الهيدروكسيل في المحلول . ويؤدي هذا الي ذوبان كمية أكبر من 2 (Mg (OH بحيث يصبح حاصل ضرب التركيزات مساوياً مرة أخرى إذابة 2 (Mg(OH
3 - منع عملية الترسيب :
لمنع عملية ترسيب ملح شحيح الذوبان فإنه يلزم إضافة قليل من مادة تساعد على خفض تركيز أحد الأيونات بحيث لا يمكن الوصول الي قيمة حاصل الإذابة للملح شحيح الذوبان . فمثلاً لا تؤدي إضافة H2S الي ترسيب FeS من محلول حامض قوي ( HCI ) يحتوي على أيونات Fe وذلك لأن كمية H الكبيرة والناتجة مـــــن حامض الهيدروكلوريك تمنع تأين H2S ( نتيجة تأثير الأيون المشترك ) وبذلك تقلل من [ 2- S ] الى درجة لا تسمح بالوصول الي قيمة حاصل إذابة FeS .
مثال 10 :
احسب حاصل الإذابة لكرومات الفضة AgCrO4( الوزن الجزيئي هو 332 ) إذا علمت أن ذوبانيتها هي 0.022 جم / لتر ؟
الحل :
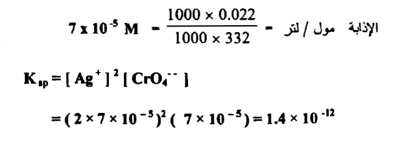
مثال 11 :
تترسب الفضة في محلول بإضافة أيون الكلوريد في محلول حجمه 500 سم 3 ما هو تركيز أيون الكلوريد إذا لم يبق أكثر من 0.1 ملجم من الفضة غير مترسب ؟
الحل :
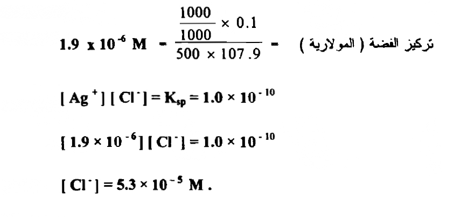
مثال 12 :
احسب كمية الإذابة بالجم / لتر لهيدروكسيد الرصاص 2 (Pb (OH إذا علمت أن حاصل الإذابة لـ 2 ( OH ) هي 16-10 × 2.5 ؟

ويمكن حساب كمية الذوبان بالجم / لتر بضرب كمية الذوبان مول / لتر × الوزن الجزيئي لهيدروكسيد الرصاص والذي يساوي 241.2
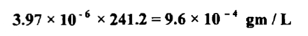
مثال 13 :
احسب تركيز أيون الأمونيوم NH4+ الناتج عن NH4CI اللازم لمنع 2(Mg (OH من الترسيب في لتر من محلول يحتوي على 0.01 مول من الأمونيا و 0.001 مول Mg+2 مع العلم أن ثابت التأين للأمونيا 5 – 10 x 1.8 وحاصل إذابــــة 2 (Mg (OH يساوي 11- 10 x 1.12
الحل :
أ - لإيجاد أكبر قيمة من [- OH | التي يمنع وجودها في محلول ترسيب Mg(OH)2

ب – لإيجاد قيمة [ 4+NH | الناتجة عن [ NH4CI | واللازمة لمنع تأين NH3 بحيث لا تزيد قيمة تركيز [ OH ] عن 4 - 10 × 1.1 مول / لتر·
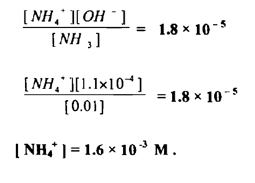


|
|
|
|
لخفض ضغط الدم.. دراسة تحدد "تمارين مهمة"
|
|
|
|
|
|
|
طال انتظارها.. ميزة جديدة من "واتساب" تعزز الخصوصية
|
|
|
|
|
|
|
مشاتل الكفيل تزيّن مجمّع أبي الفضل العبّاس (عليه السلام) بالورد استعدادًا لحفل التخرج المركزي
|
|
|