

الفاكهة والاشجار المثمرة


نخيل التمر

النخيل والتمور

آفات وامراض النخيل وطرق مكافحتها

التفاح

الرمان

التين

اشجار القشطة

الافو كادو او الزبدية

البشمله او الاكي دنيا

التوت

التين الشوكي

الجوز

الزيتون

السفرجل

العنب او الكرمة

الفستق

الكاكي او الخرما او الخرمالو

الكمثري(الاجاص)

المانجو

الموز

النبق او السدر

فاكة البابايا او الباباظ

الكيوي


الحمضيات

آفات وامراض الحمضيات

مقالات منوعة عن الحمضيات


الاشجار ذات النواة الحجرية

الاجاص او البرقوق

الخوخ او الدراق

الكرز

المشمش

مواضيع عامة

اللوز

الفراولة او الشليك

الجوافة

الخروب(الخرنوب)

الاناناس

مواضيع متنوعة عن اشجار الفاكهة

التمر هندي

الكستناء

شجرة البيكان ( البيقان )

البندق


المحاصيل


المحاصيل البقولية

الباقلاء (الفول)

الحمص

الترمس

العدس

الماش

اللوبياء

الفاصولياء

مواضيع متنوعة عن البقوليات

فاصوليا الليما والسيفا

محاصيل الاعلاف و المراعي


محاصيل الالياف

القطن

الكتان

القنب

الجوت و الجلجل

محصول الرامي

محصول السيسال

مواضيع متنوعة عن محاصيل الألياف


محاصيل زيتية

السمسم

فستق الحقل

فول الصويا

عباد الشمس (دوار الشمس)

العصفر (القرطم)

السلجم ( اللفت الزيتي )

مواضيع متنوعة عن المحاصيل الزيتية

الخروع


محاصيل الحبوب

الذرة

محصول الرز

محصول القمح

محصول الشعير

الشيلم

الشوفان (الهرطمان)

الدخن


محاصيل الخضر

الباذنجان

الطماطم

البطاطس(البطاطا)

محصول الفلفل

محصول الخس

البصل

الثوم


القرعيات

الخيار

الرقي (البطيخ الاحمر)

البطيخ

آفات وامراض القرعيات

مواضيع متنوعة عن القرعيات

البازلاء اوالبسلة

مواضيع متنوعة عن الخضر

الملفوف ( اللهانة او الكرنب )

القرنبيط او القرنابيط

اللفت ( الشلغم )

الفجل

السبانخ

الخرشوف ( الارضي شوكي )

الكرفس

القلقاس

الجزر

البطاطا الحلوه

القرع

الباميه

البروكلي او القرنابيط الأخضر

البنجر او الشمندر او الشوندر

عيش الغراب او المشروم او الأفطر


المحاصيل المنبهة و المحاصيل المخدرة

مواضيع متنوعة عن المحاصيل المنبهة

التبغ

التنباك

الشاي

البن ( القهوة )


المحاصيل السكرية

قصب السكر

بنجر السكر

مواضيع متنوعة عن المحاصيل


نباتات الزينة والنباتات الطبية والعطرية

نباتات الزينة

النباتات الطبية والعطرية


الحشرات النافعة


النحل

نحل العسل

عسل النحل ومنتجات النحل الاخرى

آفات وامراض النحل


دودة القز(الحرير)

آفات وامراض دودة الحرير

تربية ديدان الحرير وانتاج الحرير الطبيعي


تقنيات زراعية

الاسمدة

الزراعة العضوية

الزراعة النسيجية

الزراعة بدون تربة

الزراعة المحمية

المبيدات الزراعية

انظمة الري الحديثة


التصنيع الزراعي

تصنيع الاعلاف

صناعات غذائية

حفظ الاغذية


الانتاج الحيواني


الطيور الداجنة

الدواجن

دجاج البيض

دجاج اللحم

امراض الدواجن


الاسماك

الاسماك

الامراض التي تصيب الاسماك


الابقار والجاموس

الابقار

الجاموس

امراض الابقار والجاموس


الاغنام

الاغنام والماعز

الامراض التي تصيب الاغنام والماعز


آفات وامراض النبات وطرق مكافحتها


الحشرات

الحشرات الطبية و البيطرية

طرق ووسائل مكافحة الحشرات

الصفات الخارجية والتركيب التشريحي للحشرات

مواضيع متنوعة عن الحشرات

انواع واجناس الحشرات الضارة بالنبات

المراتب التصنيفية للحشرات


امراض النبات ومسبباتها

الفطريات والامراض التي تسببها للنبات

البكتريا والامراض التي تسببها للنبات

الفايروسات والامراض التي تسببها للنبات

الاكاروسات (الحلم)

الديدان الثعبانية (النيماتودا)

امراض النبات غير الطفيلية (الفسيولوجية) وامراض النبات الناتجة عن بعض العناصر

مواضيع متنوعة عن امراض النبات ومسبباتها


الحشائش والنباتات الضارة

الحشائش والنباتات المتطفلة

طرق ووسائل مكافحة الحشائش والنباتات المتطفلة

آفات المواد المخزونة

مواضيع متنوعة عن آفات النبات

المكائن والالات الزراعية

مواضيع متنوعة عن الزراعة
تنقية فايروسات النبات
المؤلف:
نبيل عزيز قاسم
المصدر:
فايروسات النبات (2011م)
الجزء والصفحة:
ص 339-373
23-8-2017
4211
التنقية Purification هي تحضير محلول فايروسي يحوي جسيمات مركزة وفعالة نقية غير ملوثة بأية ملوثات نباتية أو مركبات أخرى وتجرى عملية التنقية لدراسة خصائص الفايروسات الفيزيائية والكيميائية والإعداد المصول المضادة، وبدأت أولى محاولات تنقية الفايروسات عندما نجح الباحث "بايرنك" سنة 1898 بترسيب فايروس موزائيك التبغ (TMV) بالايثانول ثم تجفيفه وإعادة إذابته بالماء فاستعاد فاعليته، واستعملت طريقة التنقية بالانتباذ والترسيب بكبريتات الأمونيوم لأول مرة من قبل الباحث "ستانلي" سنة 1935 ولنفس الفايروس أعلاه والذي رسب بشكل بلورات نقية لتتوالى بعد ذلك تنقية أنواع أخرى من الفايروسات كان في مقدمتها فايروسات البطاطا أكس (PVX) والبطاطا واي (PVY) والتقزم الشجيري للطماطة (TBSV).
لقد تعددت وتطورت طرق التنقية ووظفت فيها تقانات الكيمياء الحيوية وعلم الحياة الجزيئي ورغم ذلك لا زالت العديد من أنواع الفايروسات غير ممكنة التنقية بسبب عدم ثباتيتها مما يجعلها لا تتحمل إجراءات التنقية أو لقلة تركيزها في النبات، وتعد عملية التنقية صعبة الإنجاز للأسباب الأتية (1) احتواء عصير النبات المصاب بالفايروس المطلوب تنقيته على مكونات نباتية قريبة الحجم والوزن الجزيئي من جسيمات الفايروس وهي الرايبوسومات وجزيئات انزيم Ribulose diphosphate Carboxylase والذي يسمى أيضا "جزء البروتين الأول" Fraction 1 protein حيث يبلغ قطر جزيئاته 10 نانومتر وبقيمة معامل ترسيب S18 وبوزن جزيئي 55 كيلودالتون ويشكل ما يقرب من 50% من مجمل البروتينات النباتية الذائبة في العصير النباتي وهو موجود في الكلوروبلاستات والمسئول عن تثبيت الكربون في عملية البناء الضوئي، أما البروتينات النباتية الأخرى الملوثة فهي الإنزيم المسمى "جزء البروتين الثاني Fraction 2 protein الموجود في السايتوبلازم وبقيمة معامل ترسيب S4، وبروتين "الفايتوفيريتين" Phytoferritin وبقيمة معامل ترسيب S60 وقطر 10 نانومتر كذلك تعد الصبغات النباتية من الملوثات الهامة والتي يصعب إزالتها فيما يسهل إزالة الجسيمات الخلوية الكبيرة نسبيا وهي بقايا الجدر الخلوية المحطمة والمايتوكوندريات والبلاستيدات والتي يسهل إزالتها من العصير وفصلها عن الفايروس لكبر حجمها مقارنة بجسيماته (2) تلف وتكسر العديد من جسيمات الفايروس خلال مراحل التنقية مما يربك النتيجة التنقية (3) وجود أنواع من الكاتايونات الموجبة الشحنة وخاصة أيون المغنيسيوم Mg++ والتي تسبب تكتل وتجميع الجسيمات الفايروسية سالبة الشحنة.
1. خطوات تنقية الفايروسات
تنفذ عملية التنقية لأي فايروس نباتي بثلاث خطوات متتالية وهي:
1) استخلاص الفايروس من النبات
يسحق الجزء النباتي المصاب للحصول على العصير النباتي الذي سينقى الفايروس منه لذا فمن الضروري اختيار نوع النبات المناسب لإكثار الفايروس والذي يجب أن يكون سهل التربية وخالي من المواد المثبطة للفايروس وخاصة الفينولات والأحماض العضوية والمواد اللزجة والأصماغ حيث أن النباتات التي توجد فيها هذه المواد بتركيز عالي فانه يصعب تنقية فايروساتها ومنها أشجار اللوزيات التي تحوي أوراقها تراكيز عالية من التانينات لذلك يفضل نقل فايروساتها إلى نباتات إكثار عشبية أو من الخضراوات ثم تنقيتها وعموما فان تركيز هذه المواد المثبطة يزداد كلما تقدمت النباتات في العمر، كما يجب اختيار الوقت المناسب للحصول على العصير من النبات والذي يكون فيه تركيز الفايروس في أعلى درجاته وذلك لتباين مستويات تركيز الفايروس في النباتات زمنيا وعادة ما يتناقص التركيز بعد مرور وقت طويل من إصابة نبات الإكثار بالفايروس كما يتباين تركيز الفايروسات مكانيا في النباتات أي تباين توزيع الفايروس في أجزاء النبات فقد يوجد الفايروس بتركيز عالي في الأوراق ومنخفض في الساق أو الجذور أو بالعكس وعموما فان الفايروسات المسببة للموزائيك مثلا توجد بتركيز عالي في نسيج قشرة الأوراق فيما يكون تركيزها منخفض في العروق الوسطى للأوراق ويوجد فايروس التورم الجرحي (WTV) بتركيز عالي في الأنسجة المتورمة، كما تتباين كمية الفايروسات في النباتات بتباين نوع الفايروس والنبات فمثلا يوجد فايروس موزائيك التبغ (TMV) بمقدار 2-3غم فايروس/لتر من العصير النباتي.
يتم استخلاص عصير النبات المصاب ميكانيكيا بسحق الأنسجة النباتية مع كمية معينة من محلول منظم مناسب للحصول على العصير الحاوي على الجسيمات الفايروسية الفعالة بإخراجها من الخلايا ويمكن استعمال أية وسيلة ميكانيكية لإنجاز ذلك ومنها الهاون الخزفي أو ماكينة فرم الخضراوات أو الضاغطات الميكانيكية أو الخلاطات الكهربائية، إن عملية الاستخلاص تعني إخراج الفايروس من وسطه الحيوي الطبيعي إلى العصير وهو وسط يحوي الكثير من المركبات والعوامل الخطرة على الفايروس والتي تسبب تلفه وبالتالي فشل التنقية ومنها الإنزيمات النباتية المحللة للأحماض النووية والمواد المثبطة التي ذكرت آنفا فضلا عن تأكسد الفايروس بالأكسجين الجوي وتأثير درجات الحرارة، ولغرض الحفاظ على الفايروس من هذه العوامل ولمنع تكتل الجسيمات الفايروسية في العصير وتوزيعها فيه بشكل متجانس فانه يجب اتخاذ الإجراءات التالية (1) يتم الاستخلاص في درجة حرارة لا تزيد عن 4م وذلك لان أغلب الفايروسات تفقد فاعليتها عند درجات الحرارة المرتفعة كما أن التبريد يوقف فاعلية الإنزيمات المحللة المؤثرة على الفايروس (2) استعمال المحلول المنظم المناسب للفايروس عند استخلاص العصير لضبط الأس الهيدروجيني للعصير عند حدود التعادل وذلك بسبب قدرته على سحب وإطلاق أيونات الهيدروجين في العصير وإبعاده عن نقطة التعادل الكهربائي Isoelectric point للفايروس وذلك لمنع تكتل جسيمات الفايروس في العصير وترسبها بسبب تغير الأس الهيدروجيني أثناء الاستخلاص ولضمان التوزيع المتجانس لتلك الجسيمات في المحلول، حيث أن أغلب الفايروسات تترسب عند الأس الهيدروجيني 4 والذي يمثل نقطة تعادلها الكهربائي وتنتشر بشكل متجانس عند القيمة 7 باستثناء فايروسات Bromoviruses التي تنتشر في العصير بشكل متجانس عند الأس الهيدروجيني 5 وتترسب عند القيمة 7، علما بأن عصائر العديد من أنواع النباتات هي حامضية ضعيفة وبعضها علي الحامضية مثل أوراق العنب والذي تصل قيمة أسه الهيدروجيني بين 3-4 فيما تكون عصائر القرعيات قاعدية ضعيفة، إن عملية تكتل الجسيمات الفايروسية في مرحلة الاستخلاص هي حالة غير مرغوبة لأنها ستسبب فقدان الفايروس في المراحل الأولى للتنقية خلال الانتباذ الواطئ، ومن الضروري ضبط القوة الايونية (المولاريتية) , Molarity Ionic Strength للمحلول المنظم المستعمل وذلك لتأثيرها على الفايروسات التي تتباين في تحملها لتلك القوة، فالفايروسات العصوية تناسبها القوة الايونية بقيمة 0,2 مولر فأكثر فيما نجد أنواعا من الفايروسات تفقد فاعليتها إذا وضعت في محلول منظم تزيد قوته الايونية عن 0,2 مولر (3) سحب الأيونات ثنائية الارتباط وخاصة ايوني الكالسيوم Ca++ والمغنيسيوم Mg++ من العصير حيث أن وجودها يسبب تكتل الجسيمات الفايروسية وفقدها من العصير بسبب عدم تجانس انتشارها فيه فمثلا يترسب فايروس موزائيك الجت (AMV) إذا كان تركيز أيون المغنيسيوم أكثر من 0,001مولر وتتلف جسيماته إذا تجاوز التركيز 0.1 مولر لذلك فانه يتوجب سحب هذه الايونات من العصير ويتم ذلك بإضافة مادة "الايثيلين ثنائية الامين رباعية الخلات" Ethylene diamine tetra acetate , EDTA وهي مادة مخلبية Chelating agent والتي تستعمل عادة بشكل ملح الصوديوم بتركيز 0,01 مولر وأس هيدروجيني 7,4 التي تسحب هذه الأيونات من العصير فتمنع ترسب الرايبوسومات مع الفايروس لان هذين الأيونين ضروريان لثبات الرايبوسومات وعدم تفككها عليه عند سحبهما من العصير ستتفكك الرايبوسومات ولا تترسب مع الفايروس بسبب تماثلها معه في الحجم إلا أنه يجب الحذر من استعمال هذه المادة ويقتصر على الفايروسات التي لا تحتاج لهذه الأيونات إذ من المعروف أن فايروسات Polyviruses تحتاج لمثل هذه الأيونات (4) إضافة المواد المانعة للتأكسد Antioxidants لإيقاف عمل الانزيمات المؤكسدة وأهمها إنزيمات "الفينول أوكسيديز" Phenol Oxidases الحاوية على النحاس الضروري لعملها والتي تؤكسد المواد الفينولية إلى تانينات أو كينونات وهي المواد الأكثر تأثيرا على الفايروسات حيث تتلفها وترسبها، وأهم المواد المانعة للتأكسد التي تضاف عند استخلاص الفايروس هي كبريتيت الصوديوم Sodium Sulfite وثايوكلايكوليت الصوديوم Sodium thioglycolate وهايدروكلورايد السستين Cystein hydrochloride والميركابتوايثانول Mercaptoethanol والنيكوتين Nicotine ، كما تضاف مواد مخلبية لإزالة أيونات النحاس من العصير وأهمها مادة ثنائي أثيل ثنائي كبريت الكاربامات Diethyldithiocarbamate, DIECA ومادة زانثات أثيل البوتاسيوم Potassium ethyl xanthate، كما يمكن استعمال الحليب المزال الدهن حيث تتنافس بروتيناته مع الفايروس في الارتباط بالكينونات أو ألبومين البيض للغرض ذاته، وتستعمل أيضا بولمرات تحوي على الأميدات Amides ومنها مركب "بوليفينيل البايروليدون Polyvinyl pyrolidone , PVP والتي تكون معقدات مع التانينات يتخلص منها بالترسيب، ويمكن التخلص من الانزيمات المؤكسدة للفينولات برفع الأس الهيدروجيني للعصير إلى قيمة 8-9 إن لم يكن ذلك مؤثرا على الفايروس (5) إضافة مادة البنتونايت المغنيسيومي Magnesium bentonite إلى العصير للتخلص من الإنزيمات المحللة للأحماض النووية عن طريق ادمصاصها عند الأس الهيدروجيني 6 بوجود أيون المغنيسيوم بتركيز 0,001مولر كما تدمص الرايبوسومات والبروتينات النباتية والصبغة الخضراء الناتجة من تحطم الكلوروبلاستيدات، ولكن سلبيتها هي احتمال إدمصاص الجسيمات الفايروسية عليها فتفقد من العصير فضلا عن تلوثه بجزيئات البنتونايت الدقيقة ويمكن أيضا استعمال الفحم النباتي Charcoal لادمصاص الصبغات النباتية (6) إضافة المنظفات Detergents واليوريا باعتبارها مواد ناشرة لمنع تكتل الجسيمات الفايروسية في العصير بما تسببه من إضعاف للأواصر الكاره للماء والأواصر الهيدروجينية كما تساعد في تحرير الفايروس من خلايا النبات أثناء السحق، وأهم المنظفات المستعملة هي "الترايتون أكس 100" 100 - Triton X و"التوين 80" 80-Tween وكبريتات دوديسيل الصوديوم Sodium dodecyl (laury) Sulphate, SDS و "ديوكسي كوليت الصوديوم" Sodium deoxycholate و"الايجيبون" Igepon (7) اللجوء إلى الاستخلاص الإنزيمي بدل الميكانيكي في الحالات الخاصة فقد استعمل المعقد الإنزيمي Driselase المكون من إنزيم البكتينيز Pectinase والسيليليز Cellulase لتحرير فايروس التفاف أوراق البطاطا PLRV)) من نسيج اللحاء.
2) تصفية العصير
تنفذ عملية التصفية Clarification مباشرة بعد انتهاء مرحلة الاستخلاص للتخلص من المواد النباتية الكبيرة الحجم نسبيا وفصلها عن الفايروس وتشمل المايتوكوندريات والبلاستيدات ونوى الخلايا والحبيبات النشوية وأجزاء الجدر الخلوية وأجزاء الأغشية الخلوية الليبوبروتينية إلا أن هذه الخطوة لا تتمكن من فصل المواد النباتية المماثلة في الحجم للفايروس أو الأصغر منه وتتم التصفية بإحدى الطرق التالية:
1- التصفية بالانتباذ الواطئ
الانتباذ الواطئ Low Centrifugation هو أكثر الطرق استعمالا ويتم بتعريض العصير المستخلص إلى انتباذ واطئ على قوة انتباذ1000 - 10000 Xg لمدة 15 دقيقة وهي فترة انتباذ كافية للتخلص من الجسيمات التي يزيد قطرها عن 250 نانومتر وذات معامل ترسيب يصل إلى 6500 S حيث تتجمع كل هذه المواد في الكتلة الراسبة Pellet في قعر أنبوبة الانتباذ ويتم التخلص منها ويؤخذ الرائق Supernatant الحاوي على الجسيمات الفايروسية، (الجدول 1). يمكن تحسين عملية الانتباذ بخلط العصير النباتي مع أحد أنواع المذيبات العضوية قبل إجراء الانتباذ وهي الايثانول والأسيتون ورابع كلوريد الكربون والبيوتانول والكلوروفورم والايثر ثنائي الاثيل Diethyl ether حيث يستعمل أي منها وبتركيز يناسب الفايروس المختبر إلا أن التركيز المناسب عموما هو 20% حيث تسبب دنترة العديد من المكونات النباتية الدهنية خاصة وسحب الماء منها Dehydration مما يساعد في ترسيبها بعد الانتباذ حيث تتكون عادة ثلاث طبقات في أنبوبة الانتباذ وهي الطبقة العليا المائية الحاوية على الفايروس والمواد النباتية المحبة للماء تليها طبقة البروتينات النباتية الذائبة ثم الطبقة السفلى الأكثف والتي تحوي المواد المحبة للدهون وهي المواد الشمعية والكلوروفيلات والدهون النباتية وبذلك تؤخذ الطبقة العليا فقط، يجب الحذر من زيادة تركيز المذيبات العضوية عند استعمالها لأنها قد تتلف الفايروس كما أنها لا تستعمل إطلاقا مع الفايروسات المغلفة بأغلفة ليبوبروتينية لأنها تتلفها فيما لا تؤثر على الفايروسات البسيطة لأن المذيبات العضوية هي مركبات كاره للماء بينما الفايروسات هي محبة للماء لذا فهي لا ترسبها، ولا يفضل استعمال الايثانول والأسيتون بسبب سرعة ترسيبهما للفايروسات رغم قابليتهما للامتزاج بالماء بأي نسبة خلط وأفضل المذيبات استعمالا مع الفايروسات العصوية هو الايثر ثنائي الأثيل لوحده أو ممزوجا مع رابع كلوريد الكربون رغم كونه أقل المذيبات ذوبانا في الماء حيث أن مقدار ذوبانه هو 7,5 مل / 100مل من الماء عند 20م.
الجدول (1): قوة الانتباذ والوقت اللازم لترسيب المكونات الخلوية بالانتباذ الواطئ

2- التصفية بالترشيح بالمرشحات الدقيقة
تستعمل مرشحات دقيقة تسمح للفايروسات والمواد الأصغر منها بالعبور خلالها فيما تحجز المواد النباتية الكبيرة نسبيا، وهذا يسمى بالترشيح الفائق الذي تستعمل فيه أنواع من المرشحات هي مرشح السيلايت" Celite filter الذي يحضر آنيا ويستعمل لمرة واحدة و"مرشح زايتس الاسبستي" Seitz filter ومرشح بيركفيلد" Berkefeld filter المصنوع من رمل الدياتوم DiatomaCeous earth و "امرشح شيمبرلاند" Chamberland Filter المصنوع من خزف البورسلين Porcelain و"مرشح الزجاج المتلبد" Sintered glass كما تستعمل أيضا المرشحات الغشائية أو الجزيئية Membrane or molecular filters وأهمها مرشح النايتروسيليلوز المكون من عجينة مادتي خلات ونترات السيليلوز وهذا المرشح هو عبارة عن شبكة ألياف تصنع بشكل دائري وتشبه قطع ورق الترشيح العادي ولكن بألوان الأسود أو الأبيض أو الأزرق ويتراوح حجم الجسيمات التي تعبرها بين 0.01-14 ميكروميتر ولكن أكثرها استعمالا هي ذات الثقوب بحجم 0,45 ميكروميتر ونتيجة صعوبة مرور السوائل عبرها لذا يستعمل جهاز شافط لتسهيل ذلك كما تقوم الشركات المنتجة له بطليه بمادة منظفة والكليسيرول لإزالة صفة كراهة الماء منه ومنع تكسره وبقائه مرنا، من المرشحات المستعملة حاليا هي المرشحات المصنوعة من الألياف الزجاجية (الصوف الزجاجي) Fiberglass والذي يمتاز باندفاع كبير للسوائل فيه وعدم تفاعل المواد معه ومقاومته العالية للحرارة إلا أنه غير منتظم الثقوب وأكثر أنواعه شيوعا هي التي بحجم ثقوب 0,25 ميكروميتر وتسمى الأنواع الدقيقة منها Screen filters أما المرشحات ذات الثقوب الأكبر فتسمى Depth filters لأنها تحجز المواد داخلها، استعمل أيضا "مرشح الكربونات المتعددة" Polycarbonate filter وهو غشاء مكون من طبقة واحدة من جزيئات هذه المادة لذا فهو رقيق جدا ومرن قابل للبلل ذو ثقوب اسطوانية وهو يستعمل بكثرة في زراعة الأنسجة الحيوانية.
3- التصفية باستعمال المدمصات
يمكن إجراء التصفية بمزج العصير النباتي مع مواد مدمصنة Adsorbants تقوم بادمصاص البروتينات النباتية ليسهل بعد ذلك فصلها بالترسيب بالانتباذ أو بالترشيح وأفضل المدمصات هي البنتونايت المغنيسيومي حيث يعمل أيون المغنيسيوم بمثابة جسر يربط جزيئة البنتونايت مع جزيئة البروتين ويتم منع جسيمات الفايروس من الادمصاص عليه بالتحكم بقيمة الأس الهيدروجيني.
4- التصفية بالتجميد والإذابة
هي طريقة قليلة الاستعمال وتعتمد تجميد العصير النباتي ثم إذابته ببطء فيتم عندها فصل المواد قليلة الكثافة عن بقية المكونات بسبب تجمدها بشكل كتلة ثلجية مائية طافية وهي التي تحوي عادة الجسيمات الفايروسية وبذلك تؤخذ هذه الكتلة وتبقى المواد النباتية الثقيلة غير متجمدة، تستعمل هذه الطريقة فقط مع الفايروسات الثابتة مثل فايروس موزائيك التبغ (TMV)
5- التصفية بالتسخين
هي كسابقتها قليلة الاستعمال ومع الفايروسات الثابتة فقط حيث يسخن العصير إلى درجة 60-50م لعدة دقائق مما يسبب ترسيب بعض البروتينات النباتية نتيجة تكتلها بتأثير الحرارة مما يسهل فصلها من العصير دون التأثير على الفايروسات التي تتحمل درجات حرارية أعلى من تلك الدرجة بكثير.
6- التصفية بأنظمة السوائل ثنائية الطور
تستعمل في هذه الطريقة المسماة Liquid two-phase system نوعين من البولمرات العضوية Organic polymers وأكثرها استعمالا هي الدكستران ممزوجا مع الكلايكول متعدد الايثيلين أو الأخير ممزوجا مع مثيل السليلوز حيث ينفصلان بعد المزج إلى طبقتين وعند إضافة المحلول الفايروسي غير النقي ومزجه معهما فإن الجسيمات الفايروسية ستنفصل نقية نسبيا في إحدى الطبقتين تاركة أغلب الملوثات النباتية مستقرة في الطبقة الأخرى ثم تختبر الطبقة التي يوجد فيها الفايروس ليتم التأكد من وجوده فيها بواسطة اختبارات النقاوة وتفصل عن طبقة الملوثات.
7- التصفية باستعمال المصول المضادة لبروتينات النبات
يتم تحضير مصول مضادة ضد المكونات البروتينية النباتية بالطريقة ذاتها التي يتم فيها تحضير المصول المضادة الفايروسية ولكن بحقن الحيوان اللبون بالبروتينات النباتية المنقاة من النبات السليم والذي هو من نفس نوع النبات المصاب بالفايروس ثم استعمال هذا المصل المضاد ومزجه مع المحلول الفايروسي غير النقي للتخلص من البروتينات النباتية الملوثة عن طريق ارتباط جزيئات الضد مع البروتينات المتخصصة عليها والتي تفصل بعد ذلك بالانتباذ الواطئ لتترسب بشكل كتلة راسبة، تتيح هذه الطريقة التخلص من المواد النباتية ذات الوزن الجزيئي المنخفض.
3) التنقية النهائية للفايروس
هي الخطوة التي يعزل فيها الفايروس ويفصل مركزا ونقيا عن البروتينات النباتية الذائبة والرايبوسومات والتي لم تفصل عنه في خطوة التصفية بسبب تقارب حجمها معه، تتم التنقية بإحدى الخطوات التالية والتي يعرض لها المحلول الناتج من التصفية:
1- التنقية بالانتباذ العالي
هي الطريقة الأكثر شيوعا وتعتمد تعريض المحلول الناتج من التصفية إلى انتباذ عالي Ultracentrifugation يبدأ من 20 ألف دورة/دقيقة فأكثر باستعمال جهاز الانتباذ عالي السرعة و المبرد Cooled Ultracentrifugation والدوار ثابت الزاوية Fixed angle rotor، (الشكل 1) والذي يتباين قطره وحجم حفره بتباين أنواع أجهزة الانتباذ ويجب أن لا تزيد درجة حرارة "غرفة الدوار Rotor Chamber عن 4م لمنع تصاعد الحرارة فيها بسبب الدوران السريع إلى درجات حرارة متلفة للفايروس كما تزود الغرفة بنظام تفريغ هوائي لسحب الهواء منها لما يسببه من رفع لدرجة الحرارة بسبب احتكاكه مع الدوار، يترسب الفايروس في هذه الطريقة بتأثير سرعة الانتباذ العالية في قعر أنبوبة الانتباذ بشكل كتلة راسبة Pellet تعاد إذابتها بعد التخلص من الرائق في محلول منظم مناسب إذا تمت تصفية الفايروس بطريقة الانتباذ الواطئ ثم تنقيته بالانتباذ العالي عند ذلك تسمى هذه الطريقة "الانتباذ العالي أو التمايزي Differential Centrifugation والتي تعتمد تبادل الانتباذين الواطئ والعالي مع تكرارهما لأكثر من مرة لضمان دقة التنقية.
2- التنقية بالانتباذ بمحاليل متدرجة الكثافة
تستعمل طريقة الانتباذ بمحاليل متدرج الكثافة Density gradient Centrifugation لضمان الحصول على فايروس نقي عندما تكون طريقة التنقية بالانتباذ العالي غير كافية للحصول على محلول فايروسي نقي لذلك فان هذه الطريقة تستعمل بعد الانتهاء من ترسيب الفايروس في الانتباذ العالي والذي لا زال يحوي أنواعا من الملوثات النباتية المماثلة له بالحجم لذلك يتم تعريض الراسب بعد إذابته في كمية قليلة من محلول منظم مناسب إلى الانتباذ بمحلول متدرج الكثافة المحضر مسبقا في أنابيب الانتباذ بحيث يكون طبقات كثافية متدرجة منه وتكون الطبقة السفلى هي الأعلى كثافة ثم تتدرج صعودا إلى التراكيز الأدنى، ثم يضاف المحلول الفايروسي إلى أنبوبة الانتباذ بهدوء على سطح المحلول ثم تعرض الأنبوبة إلى انتباذ علي بسرعة 40 ألف دورة/دقيقة فأكثر وباستعمال الدوار ذو الأنابيب المتأرجحة Swing-out rotor، (الشكل 1) وبذلك سينفصل الفايروس في إحدى طبقات المحلول المناسبة لكثافته التعويمية Buoyant density وحجمه وشكله ومعامل ترسيبه عن الملوثات الأخرى التي ستستقر في الطبقات الأخرى من المحلول حسب مواصفاتها أيضا، (الشكل 2) ثم تسحب طبقات المحلول بعد انتهاء الانتباذ كل على انفراد ويختبر وجود الفايروس النقي في إحداها بإخضاع المحلول إلى اختبارات النقاوة المبينة في الفقرة (2 أدناه) ثم يعرض المحلول إلى عملية الديلزة للتخلص من جزيئات المحلول الكثافي ولتركيز الفايروس في محلوله والحصول عليه نقيا وكما سيبين لاحقا.
أما محاليل التدرج الكثافي المستعملة فهي محاليل خاملة لا تتفاعل مع أي من مكونات المحلول الفايروسي ومن أهم أنواعها محلول السكروز الذي تحضر تراكيزه أنيا قبل الانتباذ إلا أنه غير مفضل مع الفايروسات غير الثابتة والفايروسات المغلفة لأنه يسبب تحطيمها لذلك يستعاض عنه بمحلول "الفايكول" Ficoll أو الكليسيرول، كما استعملت بنجاح أنواع من محاليل Salt density gradient وتشمل "كلوريد السيزيوم" , CsCL Cesium Chlorideوكبريتات السيزيوم" Cesium Sulphate وترترات البوتاسيوم Potassium tartrate و بروميد الريبيديوم Rubidium bromide وتفضل هذه الأملاح على السكروز لأنها تنفصل ذاتيا إلى طبقات متدرجة الكثافة دون الحاجة إلى إعداد تلك الطبقات كما هو الحال مع محلول السكروز، وهي تستعمل عموما مع الفايروسات التي لا تقل كثافتها عن 1.2 غم/مل، علما بان كثافة فايروسات النبات تتراوح بين 3, 1-1,45 وكثافة البروتين والحامض النووي والليبيد الفايروسي هي 1,3 و 1,7 و0.9 غم/مل وتتباين كثافة الفايروسات وأحماضها النووية حسب نوع المحلول فمثلا كانت كثافة الحامض النووي لفايروس موزائيك التبغ TMV)) 1,49 غم/مل عند استعمال السكروز فيما وصلت إلى 1,64 غم/مل مع محلول كلوريد السيزيوم.
ونظرا لما أحدثه الانتباذ بالمحاليل متدرجة الكثافة من تطوير ودقة في تنقية الفايروسات ودراسة مواصفاتها الفيزيائية فقد طورت أنواعا من هذه المحاليل لتناسب استعمالات علمية معينة وبالتالي أطلقت على الانتباذ تسميات خاصة، فقد ابتكر "المحلول المتدرج متماثل السرعة" Isokinetic gradient أيضا وهو محلول مصمم لجعل القوة الانتباذية المسلطة على الجسيمات ثابتة خلال طبقات التدريج وبذلك ستتحرك الجسيمات بسرعة ثابتة تتناسب مع معامل ترسيبها وكثافتها لذلك تسمى الطريقة التي يستعمل فيها هذا النوع من المحاليل "الانتباذ الحزمي متوازن الثقل النوعي" Isopycnic banding centrifugation وإذا استمر الانتباذ لفترة أطول من اللازم عندها سيتوازن ترسيب الجسيمات بواسطة ظاهرة الانتشار ويكون المحلول المتدرج قد وصل مرحلة التوازن الترسيبي ولن تحصل حالة تداخل الجسيمات وترسبها في قعر الأنبوبة كما في الحالة أعلاه لذلك يسمى هذا الانتباذ أيضا "الانتباذ متوازن الترسيب" Sedimentation equilibrium centrifugation.
وابتكر أيضا المحلول المتدرج متغير السرعة اللوغارتمي Linear-Log gradient حيث تتباين سرعة ترسيب الجسيمات في طبقات المحلول وبذلك فان لوغارتم المسافة التي تقطعها الجسيمات سيكون دالة لمعامل ترسيب الجسيمات أو لفترة انتباذها ويتم إيقاف هذا الانتباذ بعد فترة معينة والجسيمات لا زالت تترسب حسب شكلها وحجمها وكثافتها لان استمراره سيؤدي إلى ترسيب كل الجسيمات التي فصلت في قعر الأنبوبة، تؤثر هذه المحاليل سلبا على أنواع من الفايروسات دون غيرها لذلك يجب اختيار محلول التدرج الكثافي الذي يناسب الفايروس تحت الاختبار.
يستعمل الانتباذ بالمحلول متدرج الكثافة لتنقية الفايروسات وتقدير كثافة الفايروسات وأحماضها النووية وبروتيناتها وقياس معامل ترسيب الفايروسات في محاليلها (سرعة الترسيب) Sedimentation Coefficient or Sedimentation rate ووزنها الجزيئي ويتم ذلك باستعمال مادة قياسية معلومة للمقارنة أو بأجراء التحليلات الضوئية ومنها اختبار الانكسار الضوئي Refractometrical assay واستخراج معامل الانكسار الضوئي Refractive index باستعمال نظام شلايرين الضوئي Schlieren system أو يسمى Schlieren optics، أو يحسب رياضيا بالاعتماد على سرعة الدوران وتركيز المحلول وعوامل أخرى وتجرى هذه الدراسات باستعمال محاليل الأملاح الثقيلة وخاصة كلوريد السيزيوم مع الدنا وكبريتات السيزيوم مع الرنا حيث يمزج كل منهما مع الحامض النووي المتخصص عليه ويعرض المزيج إلى قوة انتباذية لا تقل عن 60 ألف دورة / دقيقة لمدة 24 ساعة أو أكثر وباستعمال "الدوار التحليلي" Analytical rotor المقسم إلى غرف Cells، (الشكل 1) وعندها يطلق على هذا النوع من الانتباذ مصطلح "الانتباذ التحليلي" Analytical Centrifugation وهو انتباذ يجرى لغرض الحصول على دراسات تحليلية للمكونات الفايروسية وقياس معامل ترسيب الجسيمات وليس لتنقية الفايروسات حيث يسمح الدوار التحليلي بأخذ العينات منه لغرض فحصها ضوئيا أثناء الدوران، يعتمد مبدأ عمل هذا الانتباذ على أن الجسيمات المختلفة الأحجام والموجودة في المحلول تتحرك أثناء الدوران العالي بعيدا عن السطح الهلالي المقعر للمحلول في أعلى الدوار وهي منطقة التقاء الهواء بالسائل، وبذلك سيكون كل مكون من مكونات المحلول حدا Boundary يمكن قياس حركته لتقدير سرعة ترسيب ذلك المكون اعتمادا على معامل الانكسار الضوئي حيث أن أي تغير في قيم هذا المعامل أو في قيم الامتصاصية لكل حد سيكون دالة لتركيز ذلك المكون في المحلول.، ويستعمل الدوار النطاقي Zonal rotor المقسم إلى خليتين، (الشكل 1) لإجراء الدراسات التحليلية وبذلك يطلق على الانتباذ مصطلح "الانتباذ النطاقي" Rate zonal centrifugation. يبين الشكلين (3 و 4) استعمال نظام شلايرين الضوئي لتحليل نتائج الانتباذ التحليلي للفايروسات وقياس كثافتها.
أ- عملية الفصل الغشائي (الديلزة)
الديلزة Dialysis هي فصل المواد المذابة أو العالقة في المحاليل عن بعضها بواسطة غشاء شبه منفذ Semipermable membrane وأكثرها استعمالا هما غشائي "السيليلوز الزج" Viscose Cellulose والسيلوفان Cellophane وتستعمل الديلزية بعد الانتهاء من فصل الفايروس نقيا في محلوله بالانتباذ بالمحلول متدرج الكثافة حيث تتم ديلزته للتخلص من جزيئات محلول التدرج الكثافي ولتركيز جسيمات الفايروس في المحلول وذلك بوضع المحلول الفايروسي الناتج من الانتباذ الكيس الغشائي والذي يقفل ثم يغمر في كمية مناسبة من محلول مركب محب للماء Hydrophilic Compound وأفضلها هو الكلايكول متعدد الايثيلين PEG بتركيز 20 مولر أو ألبومين البيض أو الماء المقطر في بيكر ويوضع على جهاز الرجاج المغناطيسي لتدوير الكيس داخل البيكر لمدة تصل إلى 24 ساعة وبذلك ستنتشر جزيئات محلول التدرج الكثافي والمواد النباتية صغيرة الوزن الجزيئي بواسطة ظاهرة الانتشار المقيد Restricted diffusion وتمر عبر الثقوب الدقيقة للغشاء لأن تركيزها في الماء أقل من داخل الكيس، أما جسيمات الفايروس فلا تنفذ منه لكبر حجمها النسبي حيث أن أغشية الديلزة منفذة للجزيئات التي يقل وزنها الجزيئي عن 3000 دالتون وبذلك سيركز الفايروس داخل الكيس والذي يجفف قليلا بعد انتهاء الديلزة بتعريضه لتيار هوائي بارد نسبيا دون أن يصل لمرحلة الجفاف الكامل، ويمكن الاستعاضة عن التجفيف الهوائي بطريقة "الترشيح الفراغي" Vacuum filtration تسمى "الديلزة الضاغطة" Pressure dialysis والتي يتم فيها سحب المذيب عبر الغشاء بتأثير التفريغ أو بالضغط على الكيس بعد إسناده في إطار خاص مما يجبر جزيئات المذيب على الخروج ويمكن أيضا إزالة الماء الزائد من الكيس بإضافة كمية من الاكار الجاف أو هلام "البوليدكستران" Polydextran حيث يتشبعان بالماء ويزالان من الكيس بتعريض المحلول إلى انتباذ واطئ وأخذ الرائق الحاوي على الفايروس ورمي الكتلة الراسبة.

الشكل (1): الأنواع الأربعة من الدوارات Rotors المستعملة في تنقية الفايروسات وفي الدراسات التحليلية.
(1) الدوار ذو الأنابيب المتأرجحة Swing-out rotor حيث تكون جيوب الأنابيب حرة التأرجح على الدوار وتأخذ الاتجاه العمودي على محور الدوار أثناء الانتباذ وتبدو إلى جانبه أنبوبة الانتباذ (2) الدوار ثابت الزاوية Fixed angle rotor حيث تبدو حفره الثابتة وهي جزء من جسم الدوار وتكون بزاوية ميل حادة مع محور الدوران تتباين من 18-40 درجة حسب الشركة المنتجة ويبدو غطائه إلى جانبه مع أنبوبة الانتباذ (3) الدوار التحليلي Analytical rotor ذو غرفتين والذي يستعمل مع أجهزة الانتباذ المزودة بنظام ضوئي Optical System لقياس الانكسار الضوئي تسمح بمراقبة المكونات وقياس سرعة ترسبها أثناء الدوران حيث توضع المحاليل في الخلايا المزودة بشبابيك تسمح بمرور الحزمة الضوئية الموازية لمحور الدوران (4) الدوار النطاقي Zonal rotor ذو الغرف الأربعة ويستعمل للتعامل مع كميات كبيرة من المحاليل.
الشكل مقتبس من Gibbs و Harrison((1980.

الشكل (2): طبقات محلول السكروز متدرج الكثافة المستعمل لتنقية فايروس خشخشة التبغ (TRV) المكون من جسيمتين مختلفتي الطول، أي مختلفتي الكثافة، حيث تظهر منطقتين براقتين تم فيهما فصل جسيمات الفايروس عن المواد النباتية حيث تجمعات الجسيمات الفايروسية الطويلة الأعلى كثافة في المنطقة البراقة السفلى فيما تجمعات الجسيمات الفايروسية القصيرة الأدنى كثافة في المنطقة البراقة العليا.
الشكل مقتبس من Gibbs و Harrison (1980).
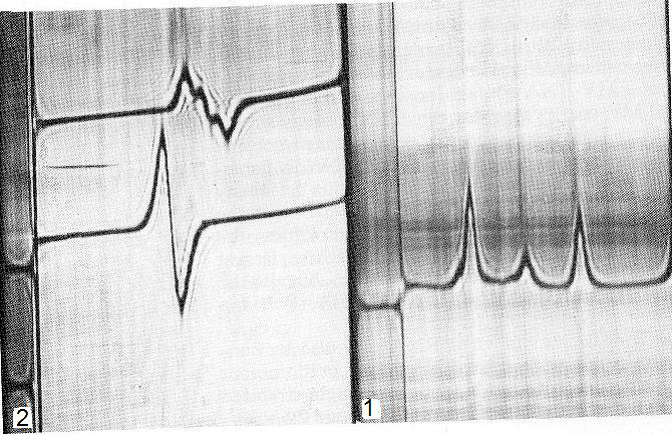
الشكل (3): نتائج "نظام شلايرين" الضوئي لتحليل نتائج الانتباذ التحليلي لنوعين من الفايروسات.
(1) مخطط نظام شلايرين لفايروس التبقع الحلقي لتوت العليق (RPRSV) المكون من ثلاث جسيمات حيث انفصلت جسيماته بالترسيب الحدي لتعطي ثلاث ذروات تمثل معامل الترسيب للجسيمات الثلاث بقيم 52 و 92 و130 S (2) مخطط نظام شلايرين لفايروس التبرقش الاصفر للوبيا (CCMV) المكون من ثلاث جسيمات باستعمال محلول كلوريد السيزيوم حيث يمثل الخط العلوي الانكسار الضوئي الذي سببته جسيمات الفايروس الثلاثة مجتمعة والتي بكثافة 1,356 و1,36 و 1,364 غم/مل والتي تتفاوت قليلا في محتواها من الحامض الرايبي، فيما يمثل الخط السفلي الانكسار الضوئي لإحدى جسيمات الفايروس التي فصلت عن الجسيمتين الاخريتين والتي بكثافة 1,36غم/مل.
الشكل مقتبس من Gibbs و Harrison (1980).
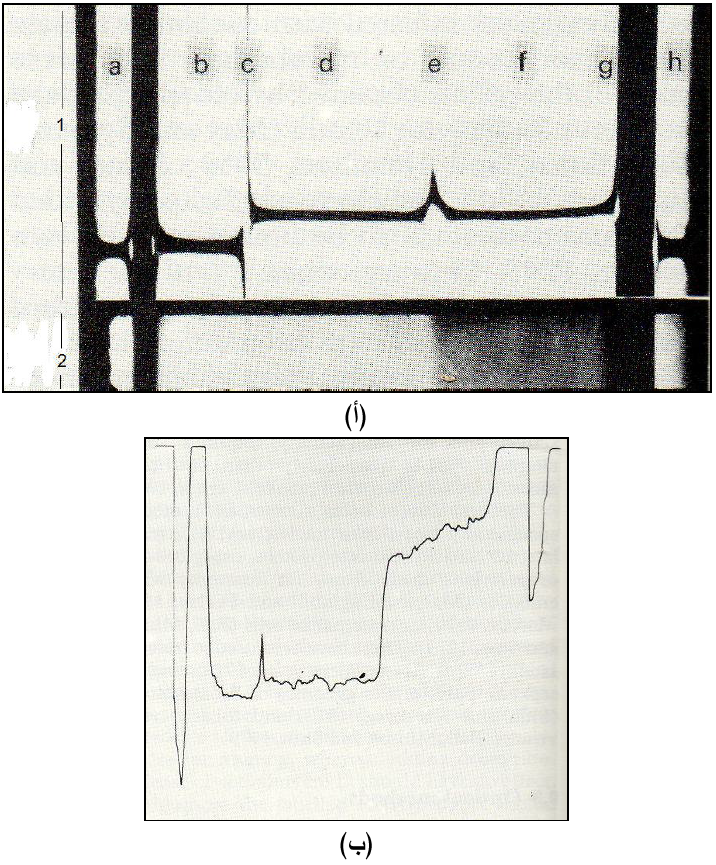
الشكل (4): نتائج "نظام شلايرين" الضوئي لتحليل نتائج الانتباذ التحليلي لفايروس الموزائيك العرقي للبرسيم الأحمر (RCVMV).
(أ) نظام شلايرين الضوئي (1) مفتاح الرموز الأفقية: a و h = خط الانكسار للعينات المأخوذة من الفتحتين الداخلية والخارجية لخلية المقارنة Reference Cell في دوار الانتباذ، أما الأحرف من b إلى g فتمثل خط الانكسار للعينات المأخوذة من الخلية التحليلية Analytical Cell لدوار الانتباذ حيث تحوي آن المنطقة b حاوية علي الهواء ومفصولة بالمنطقة C عن المحلول الفايروسي، فيما ترسبات الجسيمات الفايروسية في قعر خلية الدوار وتحديدا في المنطقتين f و g مفصولتين عن المذيب في المنطقة d بواسطة الحد .e (2)صورة لنفس مخطط النظام صورت بالأشعة فوق البنفسجية. (ب) منحنى النتائج مقاسا بجهاز قياس الكثافة الدقيق" Microdensitometer.
الشكل مقتبس من Gibbs و Harrison (1980).
ب - المبدأ الفيزيائي للانتباذ
الانتباذ (الطرد المركزي) هو تعريض محلول الجسيمات إلى قوة انتباذية Gravitational or centrifugal force مما يسبب ترسبها حسب وزنها الجزيئي وكتلتها وشكلها وحجمها ومعامل ترسيبهاSedimentation coeffecien وكثافة الوسط المذابة فيه وذلك بفعل الدوران العالي حيث ستتحرك الجسيمات في أنبوبة الانتباذ (حقل الانتباذ) لغاية تساوي قوة الانتباذ مع قوة الاحتكاك للجسيمات Fractional force وقوة التعويم المضادة لقوة الانتباذ Counteracting buoyant حيثان:
قوة الانتباذ - قوة الاحتكاك + قوة التعويم
وبذلك سترتطم الجسيمات بجدار أنبوبة الانتباذ في الدوار الثابت الزاوية وتنزلق عليه لتترسب في القعر بشكل كتلة راسبة فيما تبقى الجسيمات الأخف طافية في الجزء المائي الرائق أو ستتحرك خلال طبقات المحلول المتدرج الكثافي الدوار وهكذا يتم فصل الجسيمات المختلفة عن بعضها بتباين كثافتها وحجمها وشكلها ووفق سرعة الدوران ومدته. يعبر عن سرعة ترسيب الجسيمات بمعامل الترسيب (S) وهو مقياس لسرعة ترسيب الجسيمات في المذيب وهو دليل على لزوجة المذيب ويستعمل لقياس الوزن الجزيئي للجسيمات وتتباين قيمته بتباين المواد حيث يتراوح بين 1-20 للبروتينات و 4-100 للإحماض النووية و 70-80 للرايبوسومات و 30-500 للعضيوات الخلوية و 50 – 200 للفايروسات النباتية ويقاس معامل الترسيب بوحدة "سفيدبرج" Svedberg , S ومنها اشتق رمزه والتي تساوي 10 -13 ثانية وهي تمثل سرعة ترسيب الجسيمة في الماء عند درجة 20م عند قوة الانتباذ المستعملة ويرمز لها 20 SW أو تكتب بالصيغة S 20 , w، فمثلا إذا كانت قيمة معامل الترسيب (S) لجسيمة ما = 7 ، فهذا يعني أن سرعة (معامل) ترسيبها = 7 × 10 -13 ثانية، ويستعمل مصطلح "معامل الأداء" Performance index, Pi لتقييم كفاءة ترسيب الجسيمات عند استعمال الدوار ثابت الزاوية والذي يعتمد حساب أطول مسافة تقطعها الجسيمة لتترسب في قعر أنبوبة الانتباذ.
تتناسب سرعة الدوران طرديا مع العوامل الأتية (1) عدد دورات الدوار في الدقيقة (2) زيادة مسافة أنبوبة الانتباذ عن محور الدوران، ويرمز إلى نصف قطر الدوران بالرمز R max والذي يشير إلى المسافة بين محور الدوران ومحور أنبوبة الانتباذ (3) زيادة حجم الجسيمات وكثافتها (4) زيادة درجة حرارة المحلول في أنبوبة الانتباذ (5) زيادة لزوجة المحلول وتقاس اللزوجة بوحدة "السنتيبوز" , cP Centipose، ويستعمل مصطلح "معامل الأداء" Performance index , Pi والذي يعتمد حساب أطول مسافة تقطعها الجسيمة لتترسب في قعر أنبوبة الانتباذ في الدوار ثابت الزاوية.
يجرى الانتباذ في أجهزة الانتباذ Centrifuges والتي تتنوع نماذجها وسرعة دورانها والجزء الأساسي من الجهاز هو "الدوار" Rotor أو يسمى "الرأس" Head وهو على أنواع أربعة مبينة في الشكل (1) والذي يجلس على محور مرن وذلك لمعالجة حالة عدم التوازن التي تنتج أثناء الدوران بسبب الاختلافات الطفيفة في أوزان أنابيب الانتباذ، يدور الدوار في أجهزة الانتباذ عالية السرعة في حجرة الانتباذ المحصنة المبردة والمفرغة الهواء Refrigerated evacuated chamber وذلك لأن وجود الهواء فيها سيولد حرارة عالية نتيجة الاحتكاك مع الدوار مما يسبب تلفا للفيروسات نتيجة السرعة العالية للدوران والتي تصل إلى 75 ألف دورة /دقيقة منتجة حقلا انتباذيا Centrifugal field يصل إلى 500 ألف وحدة جاذبية (g)، أما في الانتباذ الواطئ فان سرعة الدوار تصل إلى 10 آلاف دورة / دقيقة منتجة حقلا انتباذيا يصل إلى 15 ألف دورة / دقيقة.
1- وحدات قوة الدوران
تقاس قوة الدوران بوحدة "قوة الجاذبية" Gravity force ورمزها g أو Xg والتي تمثل "قوة الانتباذ النسبية" Relative Centrifuge Force ومختصرها RCF ويطلق عليها أيضا "التعجيل الانتباذي" Centrifugal acceleration وهي القوة الانتباذية المسلطة على الجسيمات الموجودة في مركز أنبوبة الانتباذ عند سرعة دوران معينة كما تقاس سرعة الدوران بوحدة "دورة / دقيقة" ReVolution per minute ومختصرها rpm وهي الشائعة الاستعمال إلا أنها وحدة متغيرة لأنها مرتبطة بقطر الدوار المستعمل عليه يجب ذكر قيمة قطر الدوار عند استعمالها، وهناك علاقة بين هذه الوحدة ووحدة قوة الجاذبية" (g) أعلاه ففي بداية الانتباذ تكون قيمتها أدنى من قيمة "دورة / دقيقة" ولكن مع تصاعد سعة الدوران تبدأ قيمة قوة الجاذبية" بالتصاعد لتصل في ذروة الانتباذ إلى قيمة أعلى من قيمة "دورة / دقيقة"، فمثلا عند القوة 1000 g فان القيمة المقابلة لها مقاسة بوحدة "دورة / دقيقة" هي 2000، ولكن عند القوة 10000 g تصبح القيمة 7000 دورة / دقيقة، وعند القوة 100000 g تصبح القيمة 22000 دورة / دقيقة وهذه الحالة تكون أكثر وضوحا إذا كان قطر الدوار كبيرا وكلما قل نصف قطر الدوار كلما زادت قيم دورة / دقيقة" على حساب قيم قوة الجاذبية".
يمكن تحويل قيم قوة الجاذبية" إلى قيم دورة / دقيقة" وبالعكس باستعمال جداول خاصة أو باستعمال مخطط بياني بسيط Monogram تزوده الشركة المنتجة للجهاز ويمثل محوره الصادي قيم قوة الجاذبية" ومحوره السيني قيم دورة / دقيقة" مع الأخذ في الاعتبار قيم نصف قطر الدوار التي تثبت بشكل منحنيات مستقيمة في المخطط البياني وهكذا يتم معرفة القيمة المقابلة لكل منهما بإسقاط النقاط على المحورين وكما مبين في الشكل (5).
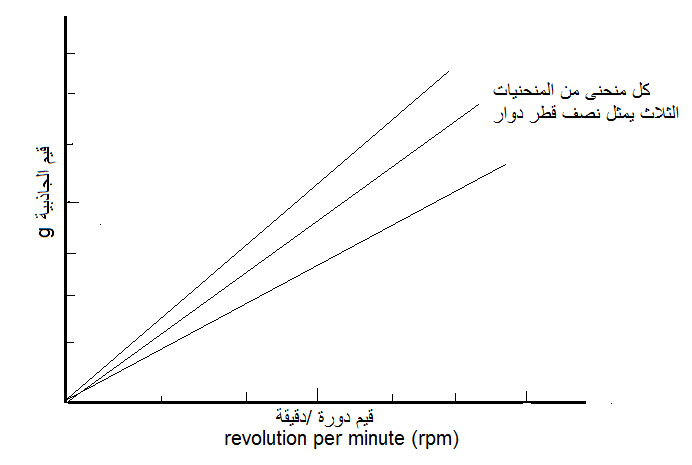
الشكل (5): المخطط البياني Monogram المستعمل لتحويل قيم "قوة الجاذبية" إلى قيم دورة / دقيقة" وبالعكس.
3- التنقية بالانتباذ والمرسبات
استعملت العديد من أنواع المرسبات Precipitants لترسيب الفايروسات أثناء الانتباذ حيث أدى استعمالها إلى زيادة كفاءة الانتباذ في التنقية وخفض السرعة اللازمة للتنقية مما يقلل الجهد الفيزيائي المسلط على الفايروسات وخصوصا تلك التي لا تتحمل مثل هذا الجهد، ويتلخص مبدأ عمل هذه المرسبات في طمس الشحنة الكهربائية السالبة للجسيمات الفايروسية مما يؤدي إلى إزاحتها من المحلول الذي كانت منتشرة فيه بشكل متجانس بسبب ظهور شحنتها ويطلق على ذلك مصطلح "الترسيب الملحي" أو "البلورة" Salt-out إلا أنه ترسيب رجعي حيث تعود الجسيمات إلى استعادة شحنتها عند إعادة تذويبها في محلول منظم مناسب، وكانت أولى المرسبات استعمالا في ترسيب الفايروسات هي كبريتات الأمونيوم Ammonium sulphate بسبب ذوبانيتها العالية في الماء حيث يبلغ حد إشباعها 53 غم/100مل من الماء علما بأنه يستعمل بمقدار ثلث حد الإشباع لترسيب الفايروسات عموما كما أنها رخيصة الثمن وأمينة على الفايروسات، إلا أن المادة الأكثر استعمالا حاليا هو مركب "الكلايكول متعدد الايثيلين" PEG , Polyethylene glycol ذو الوزن الجزيئي 6000 بتركيز يتباين بين 4 - 11 % وحسب نوع الفايروس إذ تستعمل التراكيز العالية مع الفايروسات الصغيرة الحجم والواطئة مع الفايروسات الكبيرة الحجم كما استعملت أملاح الخلات عند الأس الهيدروجيني الحامضي بقيمة 4,5 وذلك لترسيب الفايروسات البلورية وفصلها عن البروتينات النباتية. إن استعمال المرسبات للتنقية يقتصر على أنواع الفايروسات التي تتحمل القلوية العالية وهي الصفة التي تميز هذه المرسبات عموما، ويتم التخلص من جزيئات أملاح المرسبات وفصلها عن الفايروس بعد الترسيب بواسطة عملية الفصل الغشائي (الديلزية).
4- التنقية بطريقة الترشيح الهلامي
استعملت طريقة الترشيح الهلامي filtration Gel والتي تسمى "الكروماتوغرافيا المنخلية الجزيئية Molecular Sieve Chromatography لغرض تنقية عدد من أنواع الفايروسات وهي الطريقة التي تعتمد استعمال عمود من الهلام يمرر فيه المحلول الناتج من خطوة التصفية لغرض تنقية الفايروس وأكثر الهلامات استعمالا هو "السيفادكس" Sephadex ويسمى أيضا "الدكستران" Dextran وأيضا هلام "البولي أكريل أمايد" Polyacrylamide gel, PAG ويسمى ايضا Biogel P ثم هلام الاكاروز Agarose والذي يسمى أيضا "السيفاروز" Sepharose أو "البايوجيل ألفا" A Biogel وهو سكر معقد تتكرر فيه وحدات سكر الكالاكتوز ويمتاز بثباتيته عند مدى من الأس الهيدروجيني يمتد من 4-9 وكذلك عند مدى حراري يمتد من الصفر المئوي -40 م ولا يستعمل الاكار العادي لأنه يمثل الشكل غير النقي للاكاروز لاحتوائه على الاكاروبكتين Agaropectin المؤثر على الفايروسات وعلى حركتها في الهلام، وتتوفر هذه الهلامات تجاريا بشكل حبيبات Beads أو كريات Spheres وتقاس أحجامها إما على أساس تدريج حجم حبيباتها Grade أو وفق المسافات البينية بين حبيباتها في الهلام Porosity كما أستعمل هلام فوسفات الكالسيوم Calcium phosphateوالذي يسمى ايضا "هيدروكسي أباتايت" Hydroxyapatite والذي يحضر مع المحلول المنظم الفوسفاتي.
يتم الفصل الهلامي على أساس فصل الجسيمات حسب أوزانها الجزيئية والتي تتراوح بين 200-150 مليون دالتون ولكل هلام "حدود منع" Exclusion limit خاصة به فمثلا عندما تكون حدود المنع الهلام ما هي 20 × 10 6 فهذا يعني أنه يمرر الجسيمات التي يقل وزنها الجزيئي عن هذا الرقم، ويفضل عادة استعمال الهلامات ذات حدود المنع المنخفضة كي تعيق المكونات النباتية وتسمح للفايروس بالمرور عبر المسافات البينية لكرات الهلام حيث يتم فصله عن بقية الملوثات النباتية الأكبر حجما أو الأصغر منه حسب تباين سرعة مرورها في عمود الهلام ويتم الفصل بإضافة المحلول الناتج من التصفية إلى قمة العمود والسماح له بعبور الهلام وفق معدل دفق Flow rate ثابت وتستقبل أجزاء الراشح Fractions كل على انفراد من أسفل العمود وسيكون الفايروس موجود في أحدها نقيا ومفصولا عن بقية الملوثات، استعملت طريقة الترشيح الهلامي بنجاح لتنقية العديد من الفايروسات وخاصة البلورية.
5- تنقية الفايروسات بطريقة كروماتوغرافيا التبادل الأيوني
تعد "طريقة كروماتوغرافيا التبادل الأيوني lon exchange chromatography قليلة الاستعمال في تنقية الفايروسات وتستعمل فيها أعمدة من هلامات السليلوز أو فوسفات الكالسيوم أو الكايتين Chitin أو الألبومين المثيلي Methylated albumin ويستند مبدأ فصل الجسيمات في هذه الطريقة بادمصاص جسيمات الفايروس على جزيئات الهلام والسماح للجزيئات النباتية الملوثة بعبور الهلام ثم فك ارتباط جسيمات الفايروس عن جزيئات الهلام بتغيير الأس الهيدروجيني للهلام باستعمال محلول منظم يناسب النوع الفايروسي ونوع الهلام المستعمل.
6- التنقية بطريقة الترحيل الكهربائي
استعملت طرق الترحيل الكهربائي Electrophoresis بمحدودية لتنقية الفايروسات رغم أنها واسعة الاستعمال لفصل البروتينات الفايروسية وتشخيصها وتقييم نتائج التنقية، وأكثر طرق الترحيل الكهربائي استعمالا مع الفايروسات هي طريقة "الترحيل الكهربي النطاقي" Zone electrophoresis باستعمال السكروز متدرج الكثافة وتتم بإضافة المحلول الفايروسي إلى المحلول السكري المتدرج وتعريضه إلى حقل كهربي مما يسبب انفصال مكونات المحلول إلى حزم حسب شحنتها وحجمها وبالتالي فصل الفايروس نقيا في إحدى هذه الحزم واستعملت أيضا طريقة الحافة المتحركة" Moving boundary method أو تسمى "خلية تيسليوس" Tiselius electrophoresis cell بمحدودية لتنقية الفايروسات.
2. اختبارات النقاوة
اختبارات النقاوة Purity tests هي مجموعة اختبارات حيوية وفيزيائية تجرى على المحلول الفايروسي النقي لتقييم نتائج التنقية ونجاحها في تنقية الفايروس مركزا وفعالا وخاليا من الملوثات النباتية وتشمل الاختبارات التالية:
1- الاختبار الحيوي
هو اختبار تقييم الفعالية المعدية للفايروس النقي ويتم بتلقيح نباتات كاشفة حساسة للفايروس وتفضل أن تكون استجابتها له بشكل بقع موضعية ليمكن حساب النتائج كميا وهو اختبار مناسب جدا للفايروسات المنقولة ميكانيكيا أما التي لا تنقل بهذه الطريقة فيمكن تلقيح نباتات بها بحقن الفايروس في أنسجة الشتلات الغضة أو اللجوء إلى النقل بالناقلات وخصوصا الحشرات التي يتم تغذيتها على المحلول الفايروسي عبر غشاء كما أنه يعطي دليلا على تركيز الفايروس في المحلول ومقارنته مع تركيزه في نسيج النبات من خلال مقارنة عدد البقع الموضعية المتكونة على الأوراق الملقحة بالمحلول النقي وتلك الملقحة بالعصير الخام للنبات المصاب.
2- الاختبار المصلي السلبي للملوثات النباتية
يجرى باستعمال مصول مضادة للبروتينات النباتية المحتملة الملوثة للمحلول الفايروسي النقي والتي تسمى "المجسات المصلية" والتي تشمل البروتينات القريبة الوزن الجزيئي من الفايروس حيث تمزج مع المحلول الفايروسي ويفترض أنها لا تحدث أي تفاعل مصلي مع المحلول لخلوه إن كان نقيا من هذه الملوثات. يطلق على هذه المصول المضادة مصطلح "المجسات المصلية" Serological probes.
3- الفحص بالمجهر الالكتروني
يستعمل لمشاهدة الجسيمات الفايروسية مباشرة في المحلول لملاحظة سلامتها وعدم تأثير إجراءات التنقية عليها والتأثير على أشكالها وأبعادها، كما يستعمل لتقدير تركيز الجسيمات الفايروسية في المحلول بفحص قطرة معلومة الحجم منه والمقارنة مع قطرة بنفس الحجم من العصير الخام للنبات المصاب، كما يستعمل المجهر لمشاهدة البروتينات الملوثة للمحلول الفايروسي في حالة وجودها.
4- اختبار الامتصاص الطيفي للأشعة فوق البنفسجية
هو اختبار امتصاص المحلول الفايروسي للأشعة فوق البنفسجية باستعمال جهاز "المطياف" Spectrophotometer إذ تمتص الجسيمات الفايروسية هذه الأشعة عند المدى الموجي 220-300 نانومتر إلا أن أقصى امتصاص يكون عند الطول الموجي 260 نانومتر ويعود سبب الامتصاص لوجود القواعد النتروجينية الحلقية في تركيب الحامض النووي، (الشكل 6) وكذلك لوجود الاحماض الامينية وهي التربتوفان والتايروسين والفينايل ألانين في تركيب الكابسيد، (الشكل 7) لأنها أحماض أمينية أروماتية وهي تحقق أعلى امتصاص لهذه الأشعة عند 280 نانومتر وأدناه عند 250 نانومتر إلا أن الأحماض النووية تمتص هذه الأشعة بمقدار 20 ضعفا عما يمتصه البروتين، ويعد قياس قيمة الامتصاصية Absorbency , A او تسمى الكثافة الضوئية Optical density , OD دالة لقياس تركيز الفايروس في المحلول وأن العلاقة طردية بينهما أي كلما زادت قيمة الامتصاصية كلما دل ذلك على زيادة تركيز الفايروس في المحلول، (الشكل 8) كما أنه يكشف عن وجود الجسيمات المختلفة المكونة للفايروسات متعددة الجسيمات ومنها فايروس الموزائيك الأصفر للشلغم (TYMV)، (الشكل 9).
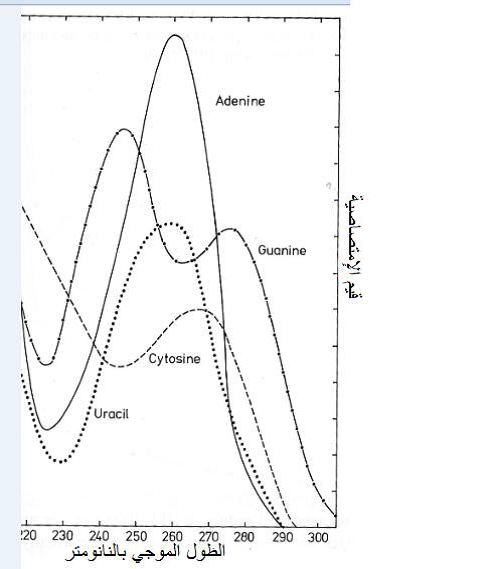
الشكل (6): الطيف الامتصاصي Absorption Spectrum للقواعد النتروجينية الأربعة وهي الأدينين والجوانين والسايتوسين واليوراسيل المكونة للحامض النووي
الرايبي.
الشكل مقتبس من Noordam (1973).
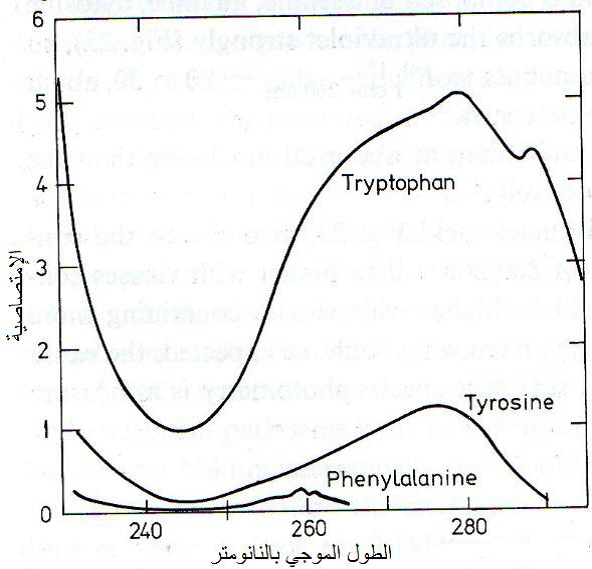
الشكل (7): الطيف الامتصاصي للاحماض الامينية وهي التربتوفان والتايروسين والفينايل الانين.
الشكل مقتبس من Noordam (1973).
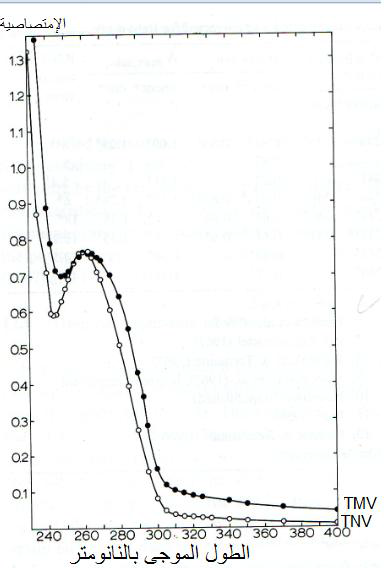
الشكل (8): الطيف الامتصاصي لفايروسي موزائيك التبغ (TMV) وموت التبغ (TNV) واللذان بتركيز 0.25 و 0.13 ملغم/ مل في المحلول الفايروسي لذا فان منحني قيم امتصاصية الاول هي اعلى من الثاني.
الشكل مقتبس من Noordam (1973).
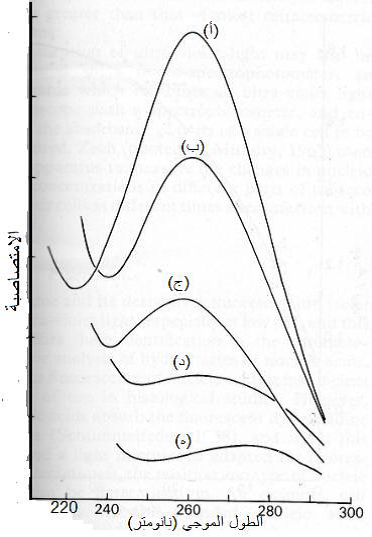
الشكل (9): الطيف الامتصاصي للمحلول النقي للجسيمتين المكونتين لفايروس الموزائيك الأصفر للشلغم (TYMV) ولحامضه النووي ولفايروسي موزائيك الخيار (CMV) وموزائيك التبغ (TMV) : (أ) : الطيف الامتصاصي لمحلول الحامض النووي الرايبي النقيRNA لفايروس TYMV (ب) الطيف الامتصاصي المحلول الجسيمات الكاملة لفايروس TYMV والتي تحوي 33% حامض نووي (ج) الطيف الامتصاصي المحلول جسيمات فايروس CMV والتي تحوي 19% حامض نووي رايبي (د) الطيف الامتصاصي لمحلول جسيمات فايروس TMV والتي تحوي 5% حامض نووي رايبي (هـ) الطيف الامتصاصي المحلول الجسيمات البروتينية الفارغة من الحامض النووية لفايروس TYMV . كل المحاليل أعلاه تحوي الوزن ذاته من الجسيمات باستثناء العينة (أ) التي تحوي نصف مقدار ما تحويه بقية المحاليل.
الشكل مقتبس من Gibbs و Harrison (1980).
تعطي قيم الامتصاصية قيما أعلى من القيم الطبيعية بسبب "التطاير الضوئي" Light Scattering لذا فمن الضروري تصحيح القيم بحساب قيم الضوء المتطاير وطرحها من قيم الامتصاصية للحصول على قيم امتصاص حقيقية ويتم ذلك بقياس قيم التطاير بين الطولين الموجيين 315-400 نانومتر ثم تطرح من قيمة الامتصاص الكلية فنحصل على قيمة الامتصاص الحقيقية، ويكون تأثير التطاير الضوئي أكثر وضوحا مع الفايروسات العصوية إلا أن تأثيره طفيفا مع الفايروسات البلورية التي تكون بحدود 25 نانومتر لأنها لا تسبب تطايرا كبيرا للضوء عند الطول الموجي 260-280 نانومتر.
القياسات الفايروسية المستخرجة من نتائج اختبار الامتصاص الطيفي.
يستفاد من قيم الامتصاصية في استخراج القياسات الفايروسية المهمة التالية:
أ- تقدير تركيز الفايروس في النبات
يستفاد من قيم الامتصاصية لتقدير تركيز الفايروس في محلوله النقي والذي يعطي دلالة على تركيز الفايروس في نبات الإكثار المستعمل للتنقية ويتم ذلك بحساب معامل انطفاء الفايروس"0.1% Extinction coefficient , E والذي يمثل قيمة امتصاص الأشعة فوق البنفسجية عند الطول الموجي 260 نانومتر لمحلول فايروسي قياسي تركيزه 1 ملغم فايروس / مل من المحلول المنظم (المذيب) يمر فيه الضوء في حافظة المطياف Cuvette والتي بطول سنتمتر واحد ويحضر المحلول القياسي المستعمل في هذا الاختبار لأي فايروس بتجفيف الفايروس النقي ثم يذاب ملغم واحد منه في مللتر واحد من المحلول المنظم للحصول على التركيز 0.1% وتقاس امتصاصيته لتمثل معامل انطفاء ذلك الفايروس وهي قيمة مجردة بلا وحدة قياس، ولغرض توخي الدقة في قياسها لاحتمال وجود شوائب بروتينية نباتية في المحلول الفايروسي عليه تقاس الامتصاصية عند الطول الموجي 290 نانومتر وتطرح من قيمتها عند الطول الموجي 260 نانومتر وبذلك نحصل على قيمة معامل انطفاء الفايروس الفعلية ليتم بها قياس تركيز الفايروس رياضيا باستعمال المعادلة الأتية:
تركيز الفايروس في النبات (ملغم / مل عصير نباتي) = قيمة امتصاص المحلول الفايروسي النقي عند الطول الموجي 290 نانومتر / معامل انطفاء ذلك الفايروس. يبين الشكل (10) العلاقة بين قيم معامل انطفاء محاليل فايروسية نقية وبين محتواها من الاحماض النووية الرايبية. تتراوح قيم معامل انطفاء الاحماض النووية النقية الفايروسية بين 25-20 فيما يصل حاصل مجموع قيم انطفاء القواعد النتروجينية الأربع مجتمعة إلى 33 ويعود سبب انخفاض قيمته في الحامض النووي مقارنة بالقواعد النتروجينية مجتمعة إلى ارتباطها مع سكر الرايبوز والفوسفات عند تكوين النيوكليوتايدات فتنخفض امتصاصيتها للأشعة بسبب تغير خواصها الرنينية Resonance properties وبذلك تنخفض امتصاصية الحامض النووي الرايبي مفرد الخيط بنسبة 10% ومزدوج الخيط بنسبة 30%، ويطلق على هذه الظاهرة مصطلح "انخفاض الامتصاصية الضوئية" Hypochromicity لذا فان قيمة معامل انطفاء الجينومات الفايروسية من النوع dsRNA و dsDNA بحدود 20 فيما قد تصل هذه القيمة للجينوم من النوع ssRNA في الفايروسات العصوية والبلورية إلى 30 و 25 على التوالي، عندما تسخن الاحماض النووية المزدوجة فان الخيطين ينفصلان (انصهار الحامض) بسبب تحطيم الأواصر الهيدروجينية بينهما مما يجعلها أكثر امتصاصا للأشعة فوق البنفسجية وتسمى هذه الظاهرة زيادة الامتصاصية الضوئية" Hyperchromicity، (الشكل 11).
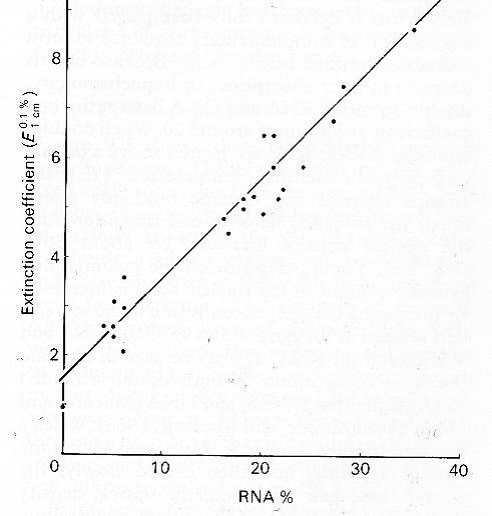
الشكل (10): منحنى العلاقة بين معامل الانطفاء عند 260 نانومتر لمحاليل نقية لأنواع من فايروسات النبات ومحتواها من الاحماض النووية الرايبية (RNA) حيث يبين الميل الانحدار الخطي لأثنين وعشرين عينة وهي النقاط الواقعة على الخط أو بقربه حيث تمثل كل منها نوعا فايروسيا معينا.
الشكل مقتبس من Gibbs و Harrison((1980.
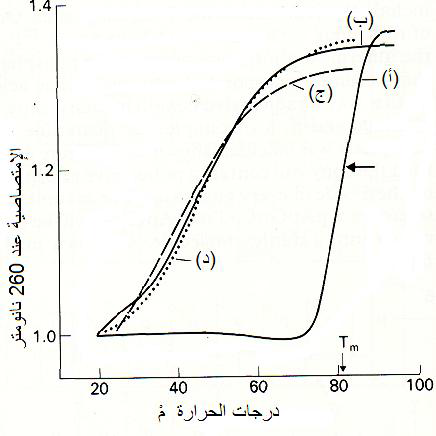
الشكل (11): حصول ظاهرة زيادة الامتصاصية الضوئية" Hyperchromicity بتأثير الزيادة التدريجية البطيئة للحرارة على محاليل أنواع من الاحماض النووية المزدوجة والتي سببت تزايد انصهار الحامض المزدوج مع تزايد درجات الحرارة.
(أ) الجينوم الرايبي المزدوج dsRNA لفايروس تقزم الرز (RDV) حيث يشير السهم إلى درجة الانصهار وهي بحدود 82 م (ب) نفس الجينوم ولكن بعد تعريضه إلى 100م ثم تبريده فورا مما أدى إلى إعادة ازدواج الخيطين فقلت قيمة الامتصاصية (ج) محلول الحامض النووي الناقل الخلوي tRNA (د) محلول الحامض النووي الرايبوسومي rRNA.
الشكل مقتبس من Gibbs و Harrison 1980)).
ب- تقدير نقاوة الفايروس في المحلول
يمكن تقدير نقاوة الفايروس في المحلول النقي وخلوه من الشوائب النباتية بقياس امتصاصيته للأشعة فوق البنفسجية عند الطولين الموجيين 260 و 280 نانومتر وذلك لاستخراج قيمة " نسبة الامتصاصية 260/280" A 260/ 280 ratio وهي ناتج قسمة قيمة الامتصاصية عند 260 نانومتر على قيمة الامتصاصية عند 280 نانومتر وتزداد قيمة هذه النسبة كلما زادت نسبة وجود الحامض النووي في الفايروس المختبر وكما مبين في الشكل (12) وتتراوح قيمة نقاوة فايروسات النبات عموما بين 1-1,8 وهي تعد وسيلة جيدة للتقدير النسبي لكمية الاحماض النووية في الفايروسات. تستعمل أيضا قيمة " نسبة الامتصاصية 260/280" A 280/260 ratio لتقدير نقاوة البروتينات الفايروسية وهي ناتج قسمة قيمة الامتصاصية عند 280 نانومتر على قيمة الامتصاصية عند 260 نانومتر وتصل قيمتها في الفايروسات النباتية إلى 2,4 وكلما زادت قيمة هذه النسبة كلما دل ذلك على احتواء الجسيمات الفايروسية على كمية بروتين أكبر، ويصل معامل انطفاء مثل هذه الفايروسات عالية المحتوى البروتيني إلى 3،1 عند 260 نانومتر.
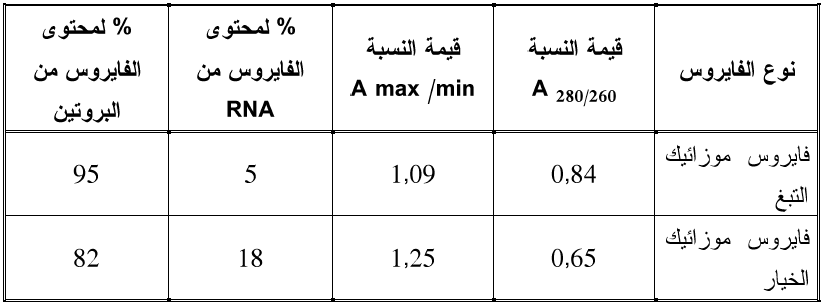
كما تستعمل أيضا قيمة أخرى لقياس نقاوة الاحماض النووية وهي "النسبة العليا / الدنيا للامتصاص Maximum/ minimum ratio ورمزها A max /min والناتجة من قسمة قيمة الامتصاصية عند 260 نانومتر على قيمتها عند 230 نانومتر وذلك لأن أعلى امتصاص يحققه الحامض النووي للأشعة فوق البنفسجية يكون عند الطول الموجي 260 نانومتر وأدناه عند الطول الموجي 230 نانومتر وتتراوح قيم هذه النسبة للإحماض النووية الفايروسية بين 2,2-2 وبالتالي فان قيمتها تكون أعلى في الفايروسات التي تحوي كمية أكبر من الحامض النووي على حساب البروتين كما أن قيمة هذه النسبة تعطي دلالة عن تركيز الفايروس في المحلول النقي وفي النبات حيث إذا كانت قيمة هذه النسبة للمحلول الفايروسي النقي تساوي ضعف مثيلتها في المقارنة فهذا يعني أن تركيز الفايروس في المحلول النقي هو ضعف مثيله في محلول المقارنة، ويوضح الجدول (2) كيفية الاستدلال بقيم النسبتين A 280/ 260 ratio و A max /min لمعرفة نسبة وجود الحامض النووي والبروتين في فايروسي موزائيك التبغ (TMV) و موزائيك الخيار (CMV) حيث يلاحظ أن قيمة النسبة 260 /280 A هي أعلى لفايروس موزائيك التبغ وذلك لان نسبة البروتين فيه هي أعلى من مثيلتها في الفايروس الثاني فيما يظهر العكس مع قيمة النسبة A max /min وذلك لارتفاع نسبة الحامض النووي في فايروس موزائيك الخيار مقارنة بالأول.
الجدول (2): قيم النسبتين 280/260 Aو A max /minلفايروسي موزائيك التبغ TMV وموزائيك CMV.
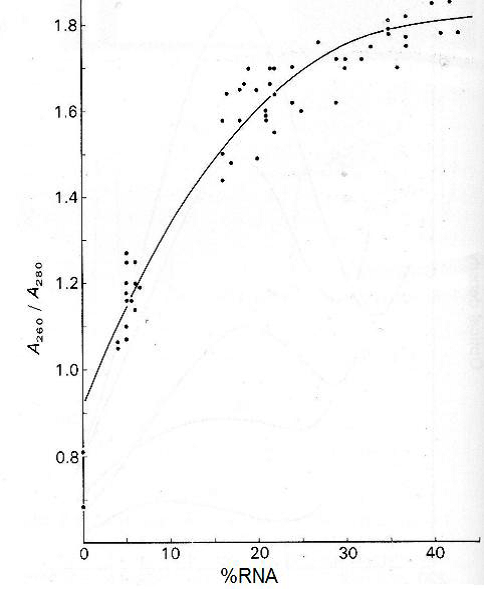
الشكل (12): منحنى العلاقة الطردية بين قيم النسبة 280/260 A ومحتوى الفايروس من الحامض النووي حيث تمثل النقاط الواقعة على الميل، عينات تمثل حوالي 52 فايروسا مختلفا.
الشكل مقتبس من Gibbs و Harrison((1980.
5- الاختبارات الضوئية
يمكن الحصول على نتائج مفيدة لتقييم التنقية باستعمال عدد من الاختبارات الضوئية
التقليدية للمحلول الفايروسي النقي باستعمال الضوء العادي وهي:
1. المشاهدة البصرية للمحلول الفايروسي النقي
يمكن بواسطة المشاهدة البصرية للمحلول الفايروسي النقي Viewing of Solution الحصول على معلومات مفيدة عن نقاوة الفايروس وشكل جسيماته حيث يظهر المحلول الفايروسي متلالنا Opalescent إذا أحتوى على جسيمات فايروسية يقل طولها أو قطرها عن 500 نانومتر أو يظهر معكرا Turbid إذا كانت أكبر من ذلك ويتم هذا الاختبار البسيط بالنظر بالعين المجردة إلى المحلول الفايروسي النقي الموضوع في أنبوبة زجاجية بوضعها أمام مسار الضوء العادي، وتحدث هذه الظاهرة بسبب تطاير الضوء الذي تسببه الجسيمات الفايروسية عند مروره في المحلول وتزداد كثافة البريق عند تعريض المحلول للضوء المنحرف Oblique light ويعطي هذا الاختبار مؤشرا على نقاوة الفايروس وحجم جزيئاته النسبي كما يعطي قياسا عاما لتركيزه في المحلول حيث أن هذه الظاهرة تحدث عندما يبلغ تركيز الفايروس في محلوله مقدار 1ملغم / مل فأكثر كما تتناسب كثافة البريق طرديا مع حجم الجسيمات والطول الموجي للضوء المتطاير.
2. التدوير الضوئي (الومضي) عند التعريض للضوء المستقطب
التدوير الضوئي Anisotropy of flow or Streaming birefringence هي خاصية ضوئية للمحاليل النقية لبعض الفايروسات حيث تومض Shimmer عند رجها والنظر إليها باتجاه ضوء مستقطب مسببة تدويره أو انحرافه وهي ظاهرة معروفة مع الفايروسات العصوية لأنها تصطف بشكل حزم فتعمل على تدوير الضوء المستقطب إذ من المعروف فيزيائيا أن المحلول المدور للضوء Birefringence Solution يغير اتجاه الضوء المستقطب بينما لا يفعل ذلك المحلول الثابت ضوئيا Isotropic solution وهذه الظاهرة هي التي نبهت الباحثين Takahashi و Rawlins سنة 1932 أن عصير نبات التبغ المصاب بفايروس موزائيك التبغ (TMV) يحوي جسيمات عصوية وكانت هذه إشارة إلى شكل هذا الفايروس قبل رؤيته بالمجهر الالكتروني، يعطي هذا الاختبار معلومات جيدة عن شكل الجسيمات الفايروسية وهيكليتها وذلك بقياس قدرة المحلول الفايروسي على التدوير الضوئي عند أطوال موجية مختلفة شاملة الأشعة فوق البنفسجية ويسمى الاختبار "التشتيت الضوئي الدوراني" Optical rotator dispersion أو ظاهرة "الثنائية اللونية التدويرية" Circular dichroism CD , أي رؤية أكثر من لون للجسم كلما تم تدويره.
3. قياس مؤشر انكسار المحلول الفايروسي
يسبب المحلول الفايروسي النقي انكسارا للضوء عند مروره فيه يزيد عن مقدار الانكسار الذي يسببه المذيب المذاب فيه الفايروس وبذلك تمتلك المحاليل الفايروسية مؤشر انكسار Refraction index يزيد عن مثيله لمحاليل الانتباذ المستعملة ويقاس بجهاز قياس الانكسار الذي يعطي تقديرا دقيقا له واستعمل هذا القياس لحساب الوزن الكلي للنيوكليوبروتينات الفايروسية منذ خمسينات القرن العشرين، مع ضرورة إجراء المعايرة اذا احتوى الفايروس على ليبيد باستعمال نظام شلايرين الضوئي Schlieren optics أو يسمى "نظام التداخل الضوئي Interference optical system لقياس تدرج معامل الانكسار للمحلول، وقد صمم شلايرين" نظامه الضوئي وذلك على أساس قدرة البروتينات على إحداث تغيير في معامل انكسار الضوء بسبب قدرة حدود مكونات المحلول البروتينية ومنها الفايروسات باعتبار أنها كتلتها الرئيسة مكونة من البروتين على تغيير مسار الضوء الذي يمر من شق طولي حيث أنه كلما زادت سرعة تغيير معامل الانكسار عند الحد كلما زاد حيود الضوء وبالتالي ستظهر حدود معامل الانكسار بشكل ذروات فوق خط أساسي وتتناسب المساحة الواقعة تحت كل ذروة مع التغيير الحاصل في معامل الانكسار عند حدود كل مكون وبالتالي فان كل مساحة واحدة منها ستمثل مكونا من مكونات المحلول البروتينية كما ستمثل أيضا تركيز ذلك المكون حيث يعمل هذا النظام بالية تجزئة الحزمة الضوئية الداخلة إلى المحلول بواسطة مرآة نصف فضية فيمر جزءا من الضوء مخترقا الجزيئات الحيوية الكبيرة المتمثلة بجسيمات الفايروس والبروتينات فتعاق حركته نسبيا مقارنة بسرعة الجزء الثاني من الضوء والذي يسمى "الجزء المرجعي" والذي يمر عبر المحلول المائي وبذلك سنحصل على معامل انكسارات مختلفة تلاحظ بعد دمج الحزمتين الضوئيتين بعد خروجهما من المحلول لتشاهد الانكسارات بشكل "حواشي ضوئية متداخلة" Interference fringes، الشكلين (3 و 4)، لقد اعتمد "نظام شلايرين" كأحد الطرق المهمة لتحليل نتائج الانتباذ بالمحاليل متدرجة الكثافة أو الانتباذ التحليلي، وهو اختبار مفيد لقياس تركيز الفايروس في المحلول اذ يتحسس وجود الفايروس اذا كان بتركيز يتراوح بين 5 ميكروغرام / مل عصير لغاية 4 ملغم / مللتر.
6- اختبارات الترحيل الكهربائي (الرحلان)
استعملت تقانة الترحيل الكهربائي (الرحلان) Electrophoresis لدراسة صفات الفايروسات ومكوناتها من الاحماض النووية والبروتينات وحساب أوزانها الجزيئية بالمقارنة مع مركبات بروتينية قياسية معروفة الوزن الجزيئي وذلك بعد فصل الحامض النووي عن البروتين الفايروسي حيث تتم عملية الفصل بطرق كيميائية وفيزيائية عديدة لا تؤثر على خواص هذه المركبات، كما استعملت بمحدودية لتنقية الفايروسات وهي تقانة تعتمد مبدأ حركة الجسيمات المشحونة في الهلام بتأثير حقل كهربائي، وأكثر أنواع الهلامات استعمالا هما هلامي البولي أكريل أمايد والاكاروز وبذلك تنفصل الجسيمات حسب اختلاف شحنتها الكهربائية مكونة حزما واضحة في الهلام يمكن فصلها نقية عن الهلام بإذابتها في مذيب مناسب، (الشكل 13) وعموما فان الفايروسات النباتية هي سالبة الشحنة في الأوساط القاعدية حيث تتفكك المجاميع الحامضية الحرة للحامضين الأمينيين "الاسبارتيك والكلوماتيك" في الكابسيد فتصبح سالبة الشحنة وتعطي هذه الصفة للجسيمة الفايروسية فيما يحصل العكس في الوسط الحامضي حيث المجاميع الحرة للحامضين المذكورين متعادلة أولا فيما ترتبط المجاميع القاعدية الحرة لأحماض اللايسين والهستدين والأرجنين مع البروتونات وتأخذ الجسيمة الفايروسية الشحنة الموجبة لذا يستعمل في الترحيل الكهربائي محاليل منظمة قاعدية لإعطاء الفايروس الشحنة السالبة وللحفاظ على ثباتيته. تعتمد سرعة الترحيل الكهربائي للجسيمات في الهلام على قيمة الشحنة ولزوجة الوسط وحجم الجسيمات وتقاس هذه السرعة بوحدة "الحركة الكهربائية المحمولة" Electrophoretic mobility ورمزها (M)، كما استعملت أنواع عديدة من تقانات الترحيل الكهربائي في الدراسات الفايروسية منها طريقة "اليوتيوب" tube method-U وطريقة "الترحيل الكهربائي النطاقي" - Zone Electrophoresis لإجراء الدراسات الكمية الفايروسية والتعرف على أبعاد الفايروسات، كما استعملت طريقة "البؤرة الكهربائية" Electrofocusing لدراسة خواص البروتينات الفايروسية ومعرفة درجة تعادلها الكهربائي وذلك عند توقف الجسيمات الفايروسية عن الحركة في الهلام لأن صافي شحنة الجسيمة الفايروسية يصبح صفرا بسبب توازن أعداد المجاميع الحامضية والقاعدية في الأحماض الأمينية الداخلة في بناء الكابسيد، وتتراوح قيمة درجة التعادل الكهربائي للفايروسات عموما بين قيمة أس هيدروجيني 3,5-6، واستعملت هذه الطريقة أيضا لدراسة أحجام الأحماض النووية الفايروسية وخاصة الرنا الفايروسي حيث يستعمل هلام البولي أكريل أمايد بتركيز 3% لفصل حامضي الرنا والدنا وذلك إذا كانت أوزانهما الجزيئية عالية (X3 –6 10 X0,3610) فيما يستعمل تركيزا أعلى من ذلك لفصل الأحماض النووية الأصغر وزنا من الرقم الأدنى أعلاه، واستعملت أيضا طريقة "الترحيل الكهربائي الورقي" Paper electrophoresis لفصل الكابسيدات الفايروسية عن بقية المكونات باستبدال الهلام بورقة ترشيح بوضع ورقة ترشيح مشبعة بالمكونات المراد فصلها في المحلول المنظم في جهاز الترحيل وبذلك ستنفصل المواد حسب شحنتها في الورقة ثم تزاح كل منها لاحقا وتذاب في مذيب مناسب.
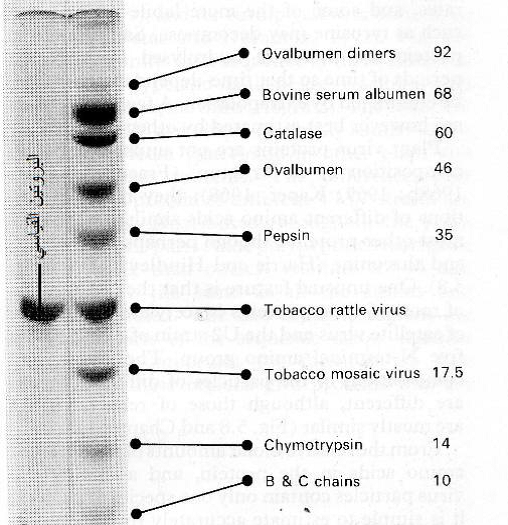
الشكل (13): استعمال تقانة الترحيل الكهربي لفصل الفايروسات وبروتيناتها وقياس أوزانها الجزيئية باستعمال هلام البولي أكريل أمايد حيث تبدو الحزم السوداء في الهلام لبروتيني فايروسي خشخشة التبغ (TRV) وموزائيك التبغ (TMV) المفصولين عن أنواع عديدة من البروتينات فيما تبدو حزمة البروتين القياسي في الشريط الأيسر المقابلة لحزمة فايروس خشخشة التبغ، تشير الأرقام إلى اليمين إلى الأوزان الجزيئية لكل بروتين.
الشكل مقتبس من Gibbs و Harrison (1980).
3. خزن المحلول الفايروسي النقي
من الضروري توفير طريقة الخزن المناسبة للمحلول الفايروسي النقي والمحافظة على فاعلية الجسيمات الفايروسية أثناء مدة الخزن حيث أن سوء الخزن يؤدي إلى نمو الفطريات والبكتريا الملوثة وبالتالي طرح إنزيمات وبروتينات غريبة في المحلول وقد تنوعت طرق الخزن وبما يناسب نوع الفايروس ولعل أكثر الطرق استعمالا هي الحفظ بالتجميد وإن كانت الفايروسات النقية تتباين في مدة تحملها لظروف التجميد حيث أن الفايروسات غير الثابتة لا تتحمل ظروف التجميد، يتم خزن المحاليل الفايروسية النقية بين الصفر المئوي و4م مع إضافة مركبات تمنع النموات الميكروبية وأكثرها استعمالا هو مركب أزايد الصوديوم بتركيز %0,1 Sodium azide وهو الأفضل من بين مواد الحفظ لعدم تأثيره على فعالية الفايروسات كما يمكن استعمال الثايمول او الكليسيرول بمزجة مع المحلول الفايروسي بنسبة 1:1 وكذلك الكلوكوز او الببتون بتركيز 5-10 % كما يمكن استعمال الكلوروفورم والفورمالديهايد بمحدودية مع بعض الفايروسات.
 الاكثر قراءة في الفايروسات والامراض التي تسببها للنبات
الاكثر قراءة في الفايروسات والامراض التي تسببها للنبات
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















