

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
الإضافة الالكتروفيلية : الآلية Electrophilic addition: mechanism
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 356
1-4-2017
13562
الإضافة الالكتروفيلية : الآلية Electrophilic addition: mechanism
قبل ان نشرع في دراسة التفاعلات الأخرى للألكنات ، لنفحص آلية التفاعلات التي ناقشناها حتى الآن. وبعد ان نفعل ذلك، سوف نعود إلى دراستنا المنهجية لتفاعلات الالكن، مستعدين لفهمها بشكل أفضل بدلالة التفاعلات الواردة في البداية.
تتضمن إضافة الكاشف الحمضي HZ خطوتين:
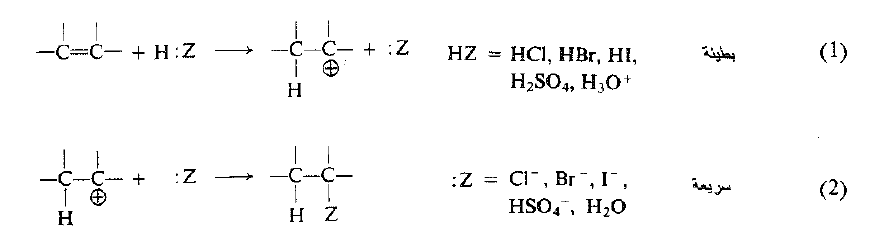
ان الخطوة (1) هي نقل ايون الهيدروجين من Z : إلى الالكن لتشكيل الكربوكاتيون: نقل البروتون من أساس* إلى آخر.

أما الخطوة (2) فهي اتحاد الكربوكاتيون مع الأساس Z:.
يمكن ان يكون الكاشف H:Z معتدلاً او مشحوناً إيجابياً : مثلاً HCl او H3O+ عندئذ، سوف يكون الأساس Z: مشحوناً سلباً او معتدلاً، مثلاً: Cl- أو H2O.
لنر ما يحدث في الخطوة (1) مركزين اهتمامنا على HZ وعلى كربوني الرابطة المزدوجة للألكن. ينتقل الهيدروجين بصفته بروتوناً بدون الكتروناته التي يتركها خلفه على الأساس Z : ولتشكيل رابطة مع الهيدروجين، يستخدم الكربون الالكترونات π التي تشارك فيها سابقاً مع الكربون الآخر. فيصبح الكربون الآخر ذا ستة الكترونات فقط، وبالتالي يصبح كربوناً معوزاً للألكترونات في الكربوكاتيون.
تكون الخطوة (1) بطيئة، وصعبة، وتتحكم سرعتها بشكل كبير وكامل في سرعة الإضافة الالكيل. تتضمن الخطوة هجوم كاشف حمضي يبحث عن الكترونات – اي الكاشف الالكتروفيلي – وبالتالي يكون التفاعل مثالاً على الإضافة الالكتروفيلية. ليس من الضروري ان يكون الالكتروفيل اللازم لنقل البروتون حمض لوري – برونستد كما هو موضح هنا، ولكن، كما سنرى، يمكن أن يكون تقريباً اي نوع من أنواع الجزيئات المعوزة الكترونياً (حمض لويس).
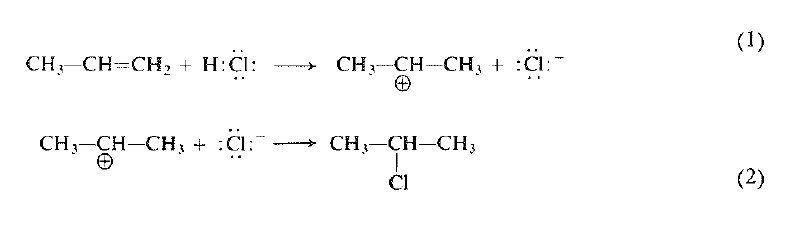
ويمكن توضيح الآلية العامة بأمثلة معينة: إضافة كلوريد الهيدروجين:
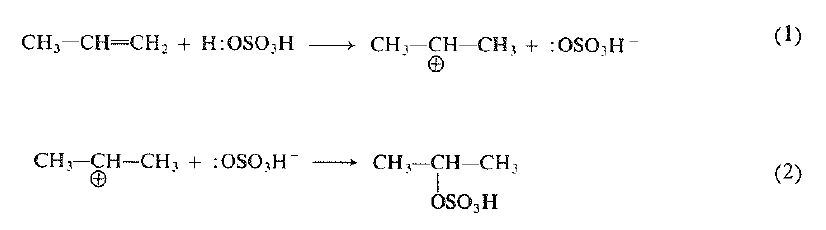
وبإضافة حمض الكبريت:
وإضافة الماء:
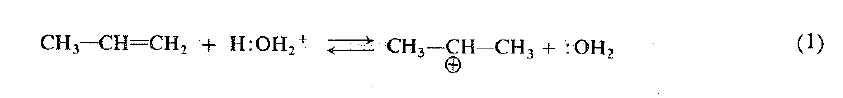
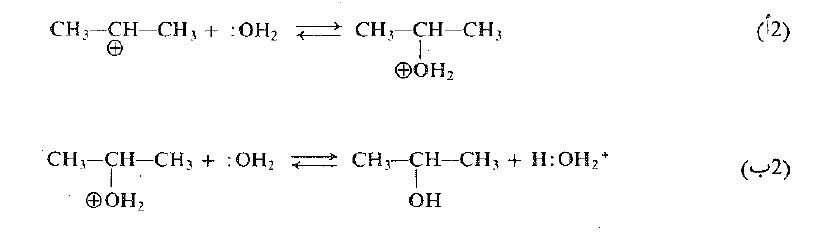
نلاحظ ان الكربوكاتيون يتحد مع الماء لا ليشكل الكحول، ولكن ليشكل الكحول المبرتن، وفي تفاعل لاحق، فإن هذا الكحول المبرتن يحرر أيون هيدروجين ويعطيه إلى أساس آخر ليشكل الكحول. وكما رأينا، فإن هذه التفاعلات المتتالية، تكون عكس ما يحدث عند نزع الماء من الكحولات. ففي نزع الماء ينزاح التوازن لمصلحة الالكن، وفي الأغلب يستخلص الالكن من مزيج التفاعل بالتقطير. أما في الإماهة فينزاح التوازن لمصلحة الكحول ويعود ذلك جزئياً إلى التراكيز العالية من الماء.
الآن، ما هو الدليل على هذه الآلية ؟ يتضمن الدليل التالي:
(أ) تعتمد سرعة التفاعل على تركيز كل من الالكن والكاشف HZ.
(ب) يتطلب التفاعل كاشفاً حمضياً.
(جـ) يترافق التفاعل، وعندما نسمح البنية، بإعادات ترتيب.
بالإَضافة إلى ذلك، فإن الآلية متوافقة مع:
(د) توجيه الإضافة.
(هـ) التفاعليات النسبية للألكنات.
لنفحص هذا الدليل:
أولاً: (أ) تعتمد سرعة التفاعل على تركيز كل من الالكن والكاشف HZ. هذه الحقيقة، طبعاً، متوافقة مع آلية تبدأ بالتفاعل بين هذين الكاشفين.
ثانياً : (ب) يتطلب التفاعل كاشفاً حمضياً . ووفقاً للآلية تكون الخطوة الأولى في كل هذه التفاعلات هي خطوة نقل البروتون إلى الالكن. يتوافق ذلك مع حقيقة ان كل الكواشف عدا الماء تعد حموضاً قوية في مفهوم لوري – برونستد ، وهذا يعني انه بإمكانها نقل البروتونات بسهولة . يتطلب الاستثناء الوحيد وهو الملاء بإضافة حمض قوي إلى التفاعل ليحدث. يعد الالكن أساساً ضعيفاً يقبل البروتونات فقط إلى درجة معينة من الحموض القوية.
اساس : قاعدة
شفع اليكتروني : مزدوج اليكتروني
 الاكثر قراءة في الهايدروكاربونات
الاكثر قراءة في الهايدروكاربونات
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















