


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
Read More
Date: 28-11-2016
Date: 19-6-2019
Date: 23-6-2019
|
Coordination number 6
For many years after Werner’s proof from stereochemical studies that many 6-coordinate complexes of chromium and cobalt had octahedral structures, it was believed that no other form of 6-coordination occurred, and a vast amount of data from X-ray diffraction studies seemed to support this. Eventually, however, examples of trigonal prismatic coordination were confirmed. The regular or nearly regular octahedral coordination sphere is found for all electronic configurations from d 0 to d10, e.g. [TiF6]2- (d0), [Ti(H2O)6]3+ (d1), [V(H2O)6]3+ (d2), [Cr(H2O(6]3+ (d3), [Mn(H2O)6]3+ (d4), [Fe(H2O)6]3+ (d5), [Fe(H2O(6]2+ (d6), [Co(H2O)6]2+ (d 7), [Ni(H2O)6]2+ (d8), [Cu(NO2)6][ (d9) and [Zn(H2O)6]2+ (d10). There are distinctions between what we later term low-spin and high-spin complexes where the distinction is meaningful, the examples listed are high-spin complexes, but many octahedral low-spin complexes are also known, e.g. [Mn(CN)6]3- (d4), [Fe(CN)6]3- (d5), [Co(CN)6]3- (d6).
Octahedral complexes of d4 and d9 metal ions tend to be tetragonally distorted, i.e. they are elongated or squashed; this is an electronic effect called Jahn–Teller distortion.
While the vast majority of 6-coordinate complexes containing simple ligands are octahedral, there is a small group of d0 or d1 metal complexes in which the metal centre is in a trigonal prismatic or distorted trigonal prismatic environment. The octahedron and trigonal prism are closely related, and can be described in terms of two triangles which are staggered (1.1) or eclipsed (1.2).
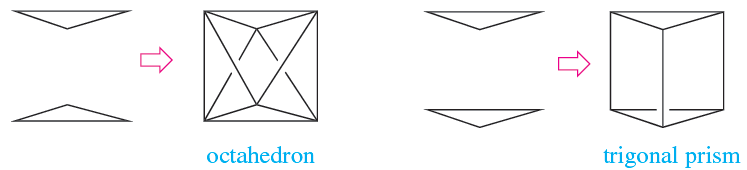
(1.1) (1.2)
The complexes [ReMe6] (d1), [TaMe6]- (d0) and [ZrMe6]2- (d0) contain regular trigonal prismatic (D3h) metal centres, while in [MoMe6] (d0), [WMe6] (d0, Figure 1.1a), [NbMe6]- (d0) and [TaPh6]- (d0) the coordination environment is distorted trigonal prismatic (C3v).
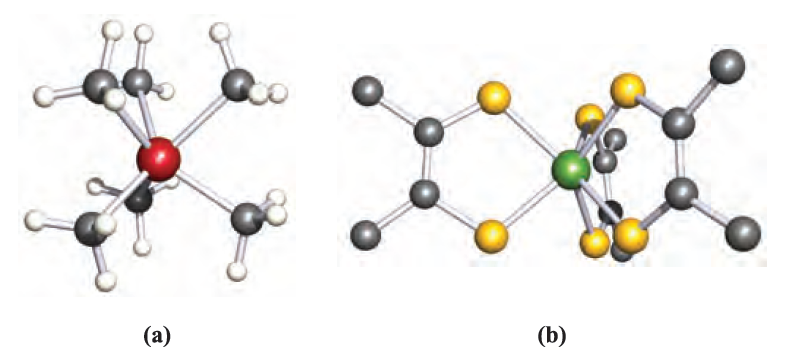
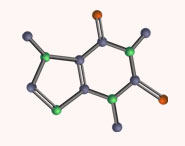
Fig. 1.1 The trigonal prismatic structures of (a) [WMe6] [V. Pfennig et al. (1996) Science, vol. 271, p.626] and (b) [Re(S2C2Ph2)3], only the ipso-C atoms of each Ph ring are shown [R. Eisenberg et al. (1966) Inorg. Chem., vol. 5, p. 411]. Hydrogen atoms are omitted from (b); colour code: W, red; Re, green; C, grey; S, yellow; H, white.
The common feature of the ligands in these complexes is that they are π-donors, with no π-donating or π-accepting properties. In [Li(TMEDA)]2[Zr(SC6H4-4-Me)6] (TMEDA = Me2NCH2CH2NMe2), the [Zr(SC6H4-4-Me)6]2- ion also has a distorted trigonal prismatic structure. Although thiolate ligands are usually weak π-donor ligands, it has been suggested that the cation–anion interactions in crystalline [Li(TMEDA)]2[Zr(SC6H4-4-Me)6] result in the RS- ligands behaving only as σ-donors. Another related group of trigonal prismatic d0, d1 or d2 metal complexes contain the dithiolate ligands, 1.3, and include [Mo(S2C2H2)3] and [Re(S2C2PH2)3] (Figure 1.1b).
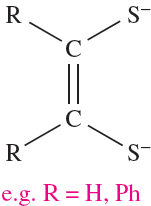
(1.3)
The complexes [WL3], [TiL3]2-, [ZrL3]2- and [HfL3]2- (L is 1.4) also possess trigonal prismatic structures. For a regular trigonal prism, angle α in 1.5 is 00 and this is observed for [TiL3]2- and [HfL3]2-. In [ZrL3]2-, α = 30, and in [WL3], α = 150. Formally, [WL3] contains W(0) and is a d6 complex, while [ML3]2_ (M=Ti, Zr, Hf) contains the metal in a _2 oxidation state. However, theoretical results for [WL3] indicate that negative charge is transferred on to the ligands. In the extreme case, the ligands can be formulated as L2- and the metal as a d0 centre.
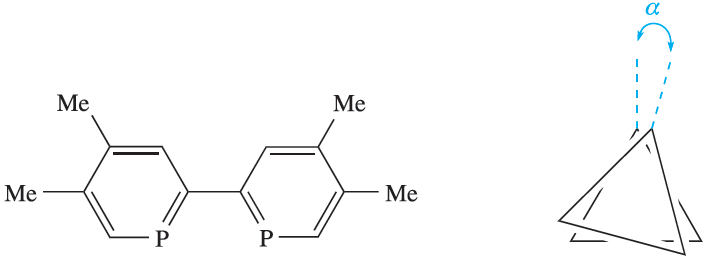
(1.4) (1.5)


|
|
|
|
دراسة يابانية لتقليل مخاطر أمراض المواليد منخفضي الوزن
|
|
|
|
|
|
|
اكتشاف أكبر مرجان في العالم قبالة سواحل جزر سليمان
|
|
|
|
|
|
|
اتحاد كليات الطب الملكية البريطانية يشيد بالمستوى العلمي لطلبة جامعة العميد وبيئتها التعليمية
|
|
|