


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 25-12-2016
التاريخ: 2025-05-03
التاريخ: 8-10-2018
التاريخ: 2024-04-23
|
تفاعل الكحولات مع هاليدات الهيدروجين . التحفيز الحمضي
Reaction of alcohols with hydrogen halides. Acid catalysis
تشتمل حموضة الكحولات بوضوح على تشطر الرابطة CO-H. عدونا نعود الآن إلى تفاعل يتضمن بوضوح، أيضاً تشطر الرابطة C-OH.
لقد رأينا ان إحدى طرائق صنع هاليدات الألكيل تحدث بتفاعل الكحولات مع هاليدات الهيدروجين دعونا ننظر إلى هذا التفاعل نظرة أكثر قرباً، ليس بوصفه طريقة اصطناعية مهمة فقط، بل بوصفه مثالاً على الاستبدال النوكليوفيلي حيث نكون الكحولات ركيزة.

وعندما نفعل ذلك فإننا سوف نرى شيئاً جديداً تماماً بالنسبة لنا: كيف اننا نستطيع تحويل زمرة سيئة جداً كزمرة مغادرة إلى زمرة مغادرة جيدة جداً وبصورة آنية، ولا يحتاج الامر إلى صب محلول من زجاجة في حوجلة.
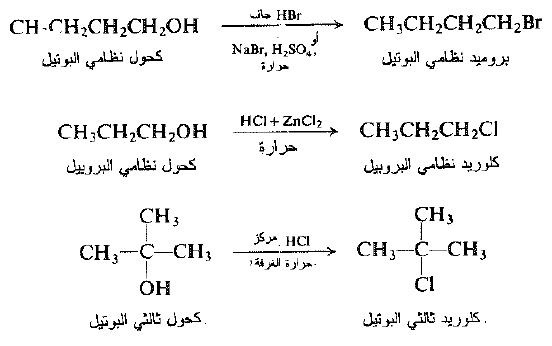
تتفاعل الكحولات بسهولة مع هاليدات الهيدروجين وتعطي هاليدات الالكيل وماء. ويجري التفاعل إما بإمرار غاز هاليد الهيدروجين الجاف في الكحول او بتسخين الكحول مع الحمض المائي المركز. يتولد بروميد الهيدروجين، في بعض الأحيان، بتفاعل حمض الكبريت مع بروميد الصوديوم، بوجود الكحول.
يتطلب هاليد الهيدروجين الأقل تفاعلية HCl ، على وجه العموم ، وجود كلوريد الزنك للتفاعل مع الكحولات الاولية والثانوية : ومن جهة ثانية يمكن ان يتحول كحول ثالثي البوتيل الشديد التفاعلية إلى كلوريد إذاً، ببساطة، يخض مع حمض الهيدروكلوريك المركز في درجة حرارة الغرفة. نذكر على سبيل المثال:
دعونا نسرد الحقائق المعروفة عن التفاعل بين الكحولات وهاليدات الهيدروجين.
(أ) يتحفز التفاعل بالحموض. فعلى الرغم من ان هاليدات الهيدروجين المائية نفسها حموض قوية، فإن إضافة حمض كبريت بسرع تشكل هاليدات الالكيل.
(ب) تحدث إعادة ترتيب الزمرة الألكيلية باستثناء معظم الكحولات الأولية. لا تمتلك الزمرة الألكيلية. في هاليد ، دوماً البنية نفسها التي تمتلكها الزمرة الألكيلية في الكحول الوالد. فعلى سبيل المثال :
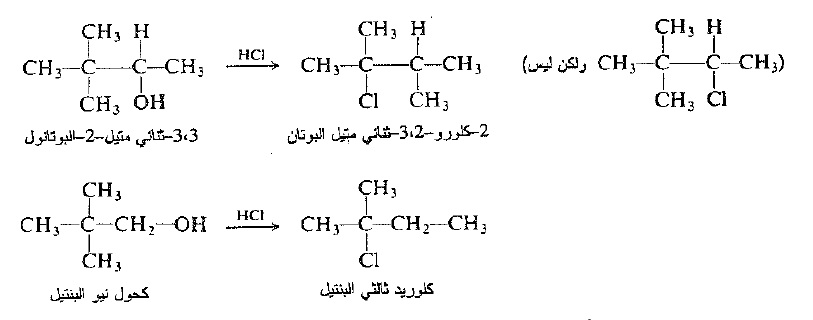
نرى ان الهالوجين لا يرتبط دوماً مع الكربون الذي حمل في الاصل الهيدروكسيل (المثال الأول) : وقد يختلف الهيكل الكربوني عما هو عليه في مادة البدء (المثال الثاني).
من جهة ثانية، تعطي معظم الكحولات الأولية مردوداً عالياً من الهاليدات الأولية من غير إعادة ترتيب، كما هو مبين فيما سبق في حالة نظامي البروميل ونظامي البوتيل.
(جـ) يكون ترتيب تفاعلية الكحولات تجاه HX كما يلي:
CH3< o1<o2<o3.
تتناقص التفاعلية خلال معظم السلاسل (وهذا الترتب هو أساس اختبار لوكاس) وتمر عبر قيمة صغرى عند 1 ْ ثم ترتفع ثانية عند CH3.
ماذا تقدم لنا الحقائق التي ذكرناها آنفاً عن آلية التفاعل بين الكحولات وهاليدات الهيدروجين؟
يقترح التحفيز بالحمض ان الكحول المبرتن R+OH2 يكون موجوداً في التفاعل. كما يقترح حدوث إعادة الترتيب ان الكاربوكاتيونات تكون متوسطة في التفاعل – علماً انها لا تكون كذلك في حالة الكحولات الأولية.
وتكون فكرة الكاربوكاتيونات مدعومة بقوة في ترتيب تفاعلية الكحولات، الذي يكون متوازياً مع استقرار الكابوكاتيونات – باستثناء حالة المتيل.
واعتماداً على هذه المعطيات يمكننا صياغة الآلية التالية: يستقبل الكحول (الخطوة 1) ايون الهيدروجين:
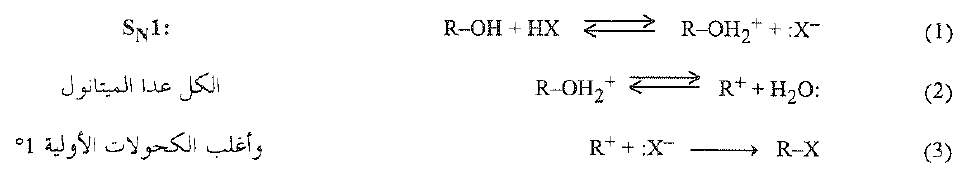
وبشكل كحولاً مبرتناً، يتفارق (الخطوة 2) إلى ماء وكاربوكايتون ، ويتحد الكاربوكاتيون بعدئذ (الخطوة 3) مع ايون الهاليد (ليس ضرورياً ان يكون الأيون المتشكل في الخطوة 1) ويشكل هاليد الألكيل.
وإذا نظرنا إلى الآلية التي كتبناها ، فإننا نعرف ما هو هذا التفاعل : انه تفاعل استبدال نوكليوفيلي ، ويكون الكحول الميرتن هو الركيزة وأيون الهاليد هو النوكليوفيل. وحالما نعرف نوع التفاعل فإن المعطيات الأخرى تكون مؤيدة له.
تشكل مجموعة المعادلات الخاصة المكتوبة سابقاً، طبعاً، الآلية SN1 من أجل الاستبدال. ولا تخضع الكحولات الأولية إلى إعادة الترتيب وذلك لأنها، ببساطة، لا تتفاعل وفق هذه الآلية. فهي بدلاً من ذلك تتفاعل وفق الآلية SN2 البديلة:
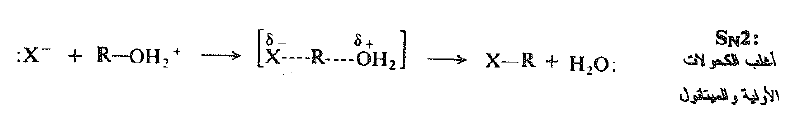
يعد ما نراه ها مثالاً آخراً على تلك الخاصة من خواص الاستبدال النوكليوفيلي: انزياح في جزيئية التفاعل يحدث، في هذه الحالة ، بين الكحولات الثانوية 2 ْ والكحولات الأولية 1 ْ . ويتأكد هذا الانزياح من حقيقة ان التفاعلية تمر عبر نهاية صغرى عند الكحولات الأولية 1 ْ وتزداد ثانية عند المتيل.
دعونا ننظر نظرة عامة إلى ما يحتمل حدوثه هنا بدءاً من النهاية المتيلية للسلسلة . تكون الركيزة المتيلية اقل مقدرة على التحلل اللامتجانس وتكون أكثر انفتاحاً تجاه الهجوم النوكليوفيلي، فهي تتفاعل بسرعة أقل من المتيل. اما الركائز الثانوية فإنها تعطي إعاقة فراغية أكبر لكنها تكون أكثر مقدرة على تشكيل الكاربوكاتيونات. ويكون التحلل اللامتجانس، من اجل هذه الركائز أسرع من الهجوم النوكليوفيلي الذي يقوم به ايون الهاليد فتتغير الآلية إلى SN1. ومع تغير الآلية تبدأ السرعة بالارتفاع. وتتفاعل الركائز الثالثية ، أيضاً، وفق الآلية SN1 : فهي تتفاعل أسرع من الركائز الثانوية بسبب التشتت الاكبر للشحنة، في الكاربوكاتيونات الابتدائية.
لقد ناقشنا حتى الآن هذا التفاعل بعبارات التصنيف المهم جداً للركائز على انها 1 ْ أو 2 ْ أو 3 ْ ولكن ينبغي ان نتذكر دائماً انه ليس هذا التصنيف – كما هو – هو المهم. بل انها العوامل الفاعلة فعلاً في هذا التفاعل : الأعاقة الفراغية تجاه الهجوم النوكليوفيلي وتشتت الشحنة في الكاربوكاتيون الابتدائي. تكون هذه العوامل – من بين اشياء أخرى – سبباً للعلاقة بين 1 ْ و 2 ْ و 3 ْ والتنافس SN1 – SN2 . كما انها تقوم بأكثر من ذلك ، فهي تستطيع جعل ركيزة أحد الاصناف تتصرف كأنها ركيزة صنف آخر، ويكون هذا السلوك مفهوماً إذا تفحصنا ببساطة البنى المعينة. دعونا ننظر في اثنين من مثل هذه الأمثلة.
يتفاعل كحول النيوبنتيل ، كما هو مبين فيما سبق، مع ‘ادة ترتيب كاملة تقريباً مبيناً انه على الرغم من كونه اولياً، فإنه يتبع آلية الكابوكاتيون. وهذا مخالف لمبدئنا العام، لكنه يسهل تعليل ذلك . فعلى الرغم من أن النيوينتيل زمرة اولية فإنها زمرة ضخمة جداً وكما رأينا تخضع الركائز النيوبنتيلية إلى التفاعلات SN2 ببطء شديد. وتشكل كاتيون النيوبنتيل هنا بطيء ايضاً، لكنه مع ذلك أسرع بكثير من التفاعل البديل الثنائي الجزيء.
أما مثالنا الآخر فهو 1 – كلورو – 2 – بروبانول. فعلى الرغم من انه كحول ثانوي من الناحية التقنية إلا انه يتفاعل مع هاليدات الهيدروجين ببطء "غير عادي" وبسرعة تقارب سرعة تفاعل كحول اولي. نحن في هذه المرة نتعامل ليس مع التأثير الفراغي بل مع التأثير القطبي.

فسرعة التفاعل SN1 تعتمد ، كما رأين على استقرارية الكاربوكاتيون الذي يتشكل . دعونا نقارن، عندئذ كاتيون -1 كلورو – 2 – بروبيل مع كاتيون ثانوي بسيط، هو على سبيل المثال كاتيون ايزو البروبيل، فالكلور الكهرسلبي يمتلك تأثير تحريضياً ساحباً للالكترونات. وهذا التأثير كما رأينا يقوي الشحنة الموجبة على الكربون المعوز الكترونياً ويجعل الكاربوكاتيون اقل استقراراً. وهذا السحب الالكتروني نفسه يقلل استقرار الكاتيون الابتدائي في الحالة الانتقالية، ويرفع الــ Eact ويبطئ التفاعل.

دعونا نعود الآن إلى الفكرة الأكثر اهمية بالنسبة لنا في تفاعل الكحول مع هاليدات الهيدروجين: التحفيز الحمضي. ما الذي يفعله الحمض؟ يحول الحمض الكحول، في الخطوة الأولى، إلى كحول مبرتن بعد الركيزة التي تخضع فعلياً للاستبدال . وفي غياب الحمض سوف يتطلب الاستبدال – بأي من الآليتين – فقدان ايون الهيدروكسيد ، وهو أساس قوي وزمرة سيئة المغادرة جداً.
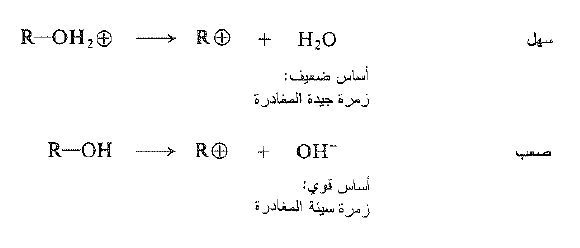
ومن جهة اخرى يتضمن الاستبدال في حالة كحول مبرتن ، بوصفه ركيزة، فقدان الماء : وهو أساس ضعيف وزمرة مغادرة جيدة. وتتضمن برتنة الكحول توازن حمض – أساس يحدث آنياً عند مزج الكواشف . وتغير الزمرة السيئة المغادرة إلى جيدة جداً وتسمح بحدوث التفاعل . وتشير الدلالة إلى ان انفصال أيون الهيدروكسيد من كحول لا يحدث مطلقاً تقريبا، فالتفاعلات المتضمنة تشطر الرابطة C – O في كحول يبدو انها تحتاج في كل حالة تقريباً إلى تحفيز حمضي الغرض منه، كما هنا، تشكيل كحول مبرتن.
تخضع الكحولات إذاً ، مثل هاليدات الالكيل إلى استبدال نوكليفيلي وفق الآليتين SN2 و SN1 ، إلا أن الكحولات تميل أكثر نحو الآلية الأحادية الجزيء . ونستطيع ان نرى، بطريقة عامة، لماذا يكون الأمر كذلك. فلكي يخضع الكحول إلى استبدال ينبغي ان يكون مبرتناً وهذا يتطلب وسطاً حمضياً. وقد رأينا أن التفاعل SN2 يكون أفضل باستخدام نوكليوفيل قوي وهذا الأمر ملائم تماماً في حالة تفاعلات هاليدات الألكيل . لكننا لا نستطيع امتلاك نوكليوفيل قوي – اساس قوي – موجود في الوسط الحمضي اللازم لبرتنة الكحول، فأي أساس اقوى من الكحول نفسه سوف يصبح مبرتناً وذلك على حساب الكحول. وإذا انحصر الار، عندئذ، بالتفاعل مع كواشف ضعيفة الأساسية وضعيفة النوكليوفيلية فإن الكحولات تتفاعل بشكل رئيسي وفق آلية الكربوكاتيون.
لقد أشير في مقدمة هذا الفصل إلى ان البرتنة تعد، طبعا، التأثير التحفيزي الأكثر اهمية – وبساطة – في الكيمياء العضوية . ففي وجود حمض يتبرتن العديد من انواع الذرات الموجودة في المركبات العضوية إلى درجة كبيرة ؛ يتبرتن الاكسجين والنتروجين والكبريت وحتى الكربون، في بعض الأحيان. وكما سنرى في كل فصل من فصول هذا الكتاب تقريباً ان هذه البرتنة تمارس تأثيرات قوية في أنواع عديدة من التفاعلات المتضمنة تقريباً كل صنف من المركبات.


|
|
|
|
لشعر لامع وكثيف وصحي.. وصفة تكشف "سرا آسيويا" قديما
|
|
|
|
|
|
|
كيفية الحفاظ على فرامل السيارة لضمان الأمان المثالي
|
|
|
|
|
|
|
العتبة العباسية المقدسة تجري القرعة الخاصة بأداء مناسك الحج لمنتسبيها
|
|
|