

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
سرعة التفاعل Rate of reaction
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 57 - 6th ed
8-11-2016
4474
سرعة التفاعل Rate of reaction
يحصل التفاعل الكيميائي نتيجة لتصادمات ذات طاقة كافية وتوجه مناسب. وهكذا، تكون سرعة التفاعل هي السرعة التي تحدث وفقها التصادمات الفعالة، لنقل أنها عدد التصادمات الفعالة التي تنجز في كل ثانية بالنسبة لكل ليتر من حيز التفاعل.
نستطيع، إذن، التعبير عن السرعة بحداء الثلاثة عوامل (العدد الذي يعبر عن احتمال وقوع تصادم ما ويملك التوجه المناسب بشكل عام يدعى، عامل الاحتمال Probability factor). يستطيع كل شيء يؤثر في أي من هذه العوامل، أن يؤثر في سرعة التفاعل.

يتعلق تواتر التصادم بـ (أ) مقدار تقارب الجسيمات من بعضها، أي التركيز أو الضغط؛ (ب) بحجم الجسيمات (جـ) بسرعة تحركها، التي تتعلق بأوزانها وبدرجة الحرارة.
نستطيع تغير التركيز ودرجة الحرارة، وبالتالي نغير السرعة. ولابد أن تكون على معرفة بالحقيقة التي تقول: إن زيادة التركيز تؤدي الى زيادة السرعة، ويحدث ذلك، بالطبع، بزيادة تواتر التصادم. إن رفع درجة الحرارة يؤدي الى زيادة تواتر التصادم؛ وكما سنرى، يؤدي، كذلك، الى زيادة عامل الطاقة، وإن هذا الأخير كبير جداً بحيث يغدو تأثير درجة الحرارة في تواتر التصادم بالمقارنة غير مهم.
إن حجم الجسيمات ووزنها، من الصفات المميزة لكل تفاعل التي لا يمكن تغييرها. وعلى الرغم من أنها تتباين بشكل واسع، من تفاعل الى آخر فإنه هذا التباين لا يؤثر كثيراً في تواتر التصادم. إن الوزن الثقيل يجعل حركة الجسيم أبطأ، في درجة حرارة معطاة، وبالتالي يؤدي الى خفض تواتر التصادم. وبشكل عام، يكون الجسيم الأثقل أكبر حجماً ويميل الحجم الكبير الى زيادة تواتر التصادم. وبالتالي يميل هذان العاملان الى إفناء أحدهما الآخر.
يتعلق عامل الاحتمال بأبعاد الجسيمات الهندسية وبنوع التفاعل الجاري. وهو لا يتغير كثيراً في التفاعلات المتقاربة.
إن الطاقة الحركية للجزيئات المتحركة ليست هي المصدر الوحيد للطاقة اللازمة للتفاعل، إذ يمكن أن تتولد الطاقة، مثلاً، من اهتزاز مختلف الذرات ضمن الجزيء. لا يتعلق عامل الاحتمال فقط بنوعية الذرات في الجزيء والتي تعاني التصادم، بل وبنوع ترتب الذرات (وضعية الذرات) الأخرى في الجزيء وقت التصادم أيضاً. إن عامل الطاقة هو العامل الأكثر أهمية في تعيين السرعة إنه جزء التصادمات ذات الطاقة الكافية. ويتعلق هذا العامل بدرجة الحرارة التي نستطيع التحكم بها، وبطاقة التنشيط، التي هي من ميزات (تميز) كل تفاعل.
تملك جزيئات ذات مقاس معين، في درجة حرارة معينة، سرعة وسطية، وبالتالي طاقة حركية وسطية تميز هذه المنظومة؛ في الواقع، إن درجة الحرارة هي قياس لهذه الطاقة الحركية الوسطية. غير أن الجزيئات المفردة لا تتحرك جميعها بذات السرعة، بل بعضها يتحرك بسرعة أكبر من السرعة الوسطية وبعضها بسرعة أقل. يوضح توزع الطاقة الحركية في الشكل (1.1) بمنحن على شكل جرس يصف التوزع الكائن بين أفراد لها صفات مختلفة مثل الطول والذكاء والدخل وحتى العمر المتوقع.
يكون عدد الجزيئات، ذات الطاقة الحركية القريبة من القيمة الوسطية أعظم ما يمكن، ويتناقص هذا العدد عندما تصبح الطاقة أكبر أو أصغر من هذه القيمة الوسطية.
يعطى توزع طاقات التصادم، كما هو متوقع باستخدام منحني مشابه (2.1). ولنشير الى التصادمات ذات الطاقة المعنية (Eact) بخط عمودي. يشار الى عدد التصادمات ذات الطاقة المساوية (Eact) أو الأكبر منها بالمنطقة المظللة
تحت المنحني والى يمين الخط العمودي. وبالتالي يكون الكسر من عدد التصادمات الكيل، الذي يملك هذه الطاقة الدنيا، (Eact) هو كامل الجزء المظلل من المنطقة المبينة على المخطط.

الشكل 1.1: توزع الطاقة الحركية بين الجزيئات

الشكل 2.1: توزع الطاقة الحركية بين التصادمات
من الواضح أنه كلما كانت طاقة التنشيط كبيرة كانت نسبة عدد التصادمات التي تملك هذه الطاقة أقل. وتكون العلاقة الفعلية بين طاقة التنشيط وجزء التصادمات الذي يملك تلك الطاقة، هي:

وبالرمز بـ (P) لعامل الاحتمال، و(Z) لتواتر التصادم، نصل الى علاقة السرعة التميكانيكية:
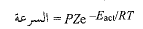
تبقى هذه العلاقة الأسية مهمة بالنسبة لنا، إذ أنها تشير الى أن فرقاً صغيراً في (Eact) يكون ذا أثر كبير على جزء التصادم ذي الطاقة الكافية، وبالتالي على سرعة التفاعل.
فعلى سبيل المثال، نجد أنه، من بين مليون من التصادمات في درجة الحرارة (275˚س)، يوجد (10000) تصادم فقط يملك ما يكفي من الطاقة إذ كانت 5 – Eact كيلو حريرة و(100) تصادم يملك ما يكفي من الطاقة إذا كانت 10 – Eact كيلو حريرة وتصادم واحد، فقط، يملك ما يكفي من الطاقة إذا كانت 15 – Eact كيلو حريرة.
ويعني هذا أن (إذا بقية الشروط الأخرى ثابتة) تفاعلاً له 5 = Eact كيلو حريرة يجري بسرعة أكبر بـ (100) مرة من آخر له 15 = Eact كيلو حريرة.
لقد عالجنا حتى الآن منظومة في درجة حرارة معينة. تؤدي الزيادة في درجة الحرارة، طبعاً، الى زيادة معدل الطاقة الحركية ومعدل السرع، وعليه فإنها تزيح كامل المنحنى الى اليمين، كما هو مبين في الشكل (3.1). عندئذٍ، من أجل طاقة تنشيط معينة فإن الزيادة في درجة الحرارة تؤدي الى زيادة جزء التصادمات ذات الطاقة الكافية، ومن ثم تزيد السرعة, كما نعلم.
تؤدي هذه العلاقة الأسية ثانية الى تغير كبير في السرعة، هذه المرة، من أجل تغير صغير في درجة الحرارة. فعلى سبيل المثال، تؤدي زيادة درجة الحرارة من (250˚س) الى (300˚س) والتي تمثل زيادة قدرها (10%) فقط في درجة الحرارة، الى زيادة في السرعة تعادل نحو 50%، إذا كانت 5 – Eact كيلو حريرة، والى مضاعفة السرعة إذا كانت 10 – Eact كيلو حريرة. وكما يظهر هذا المثال، كلما ازدادت طاقة التنشيط كان تأثير درجة الحرارة أكبر حيث تقاس السرعة في درجات حرارة مختلفة، ومن النتائج تحسب (Eact).
لقد تفحصنا العوامل التي تحدد سرعة التفاعل. وما تعلمناه قد يستخدم بعدة طرق على سبيل المثال لتسريع تفاعل معين، يجب رفع درجة الحرارة أو زيادة تركيز المتفاعلات، أو حتى (بأساليب نعتمدها لاحقاً) بتصغير قيمة طاقة التنشيط (Eact).
على كل حال، تبقى التفاعليات النسبية هي الاهتمام الحالي. ولهذا دعونا نرى كيف تستطيع معلوماتنا عن سرعة التفاعل، مساعدتنا في تفسير السبب الذي يجعل تفاعلاً يجري أسرع من الآخر علماً أن التفاعلين يخضعان الى نفس الشروط.

الشكل 3.1: تغير طاقة التصادم بتغير درجة الحرارة
 الاكثر قراءة في الهايدروكاربونات
الاكثر قراءة في الهايدروكاربونات
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















