
الرابطة الكيميائية قبل 1926 The chemical bond before 1926
 المؤلف:
Robert T. Morrison & Robert. N Boy
المؤلف:
Robert T. Morrison & Robert. N Boy
 المصدر:
الكيمياء العضوية Organic chemistry
المصدر:
الكيمياء العضوية Organic chemistry
 الجزء والصفحة:
p 6th ed
الجزء والصفحة:
p 6th ed
 31-10-2016
31-10-2016
 4348
4348
الرابطة الكيميائية قبل 1926 The chemical bond before 1926
يجب أن يبدأ أي اعتبار لبنية الجزيئات بمناقشة الروابط الكيميائية، تلك القوى التي تربط الذرات ببعضها البعض في الجزيء.
ستناقش الروابط الكيميائية، أولاً، في إطار النظرية التي طورت حتى عام 1926، ومن ثم في إطار النظرية الحالية لقد أدى إدخال ميكانيك الكم عام 1926، الى احداث تغيير جذري في المفاهيم حول كيفية تشكل الجزيئات وللملائمة ما زالت اللغة الأقدم والأبسط والتمثيلات التصويرية، تستخدم على الرغم من أن الكلمات والصور تعطي تفسيرات حديثة.
في عام 1916 وصف نوعان من الروابط الكيميائية: الرابطة الأيونية من قبل فالتر كوسل W.kossel (من ألمانيا)، والرابطة التكافؤية من قبل لويس G.N.Lewis (من جامعة كاليفورنيا). كلاهما، بنى أفكاره على أساس المفهوم التالي للذرة.
تحاط النوى الموجبة الشحنة بالالكترونات المرتبة في طبقات أو سويات طاقة متطابقة المركز. هنالك عدد أعظمي للالكترونات التي يمكن توضعها في كل طبقة: الكترونات في الطبقة الأولى، ثمانية في الطبقة الثانية، ثمانية أو ثمانية عشر في الطبقة الثالثة، وهكذا. تبلغ الاستقرارية العظمى عندما تكون الطبقة الخارجية مليئة، كما هي الحال في الغازات النادرة ينشأ كلا نوعي الروابط، الأيوني أو التكافؤي، من ميل الذرات لبلوغ هذا التشكيل الالكتروني المستقر.
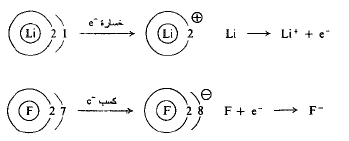
تحصل الروابط الأيونية من انتقال الالكترونات، كما في تشكيل فلوريد الليثيوم. على سبيل المثال، تملك ذرة الليثيوم الكترونين في طبقتها الداخلية والكتروناً في طبقتها الخارجية أو طبقة التكافؤ؛ يؤدي فقدان الكترون الى حمل الليثيوم ذا طبقة خارجية مليئة بزوج من الالكترونات. بينما تملك ذرة الفلور الكترونين في الطبقة الداخلية، وسبعة الكترونات في الطبقة الخارجية، طبقة التكافؤ؛ ويؤدي كسب الكترون واحد الى جعل الفلور ذا طبقة خارجية ممتثلة بثمانية الكترونات. يتشكل فلوريد الليثيوم، بانتقال الكترون من الليثيوم الى الفلور؛ يصبح الآن الليثيوم يحمل شحنة موجبة، والفلور يحمل شحنة سالبة. يسمى التجاذب الكهرساكن، بين الأيونات متعاكسة الشحنة، الرابطة الأيونية. تكون الروابط الأيونية، نوعية، في الأملاح المشكلة من اتحاد العناصر المعدنية (عناصر كهرجابية) الموجودة الى أقصى يسار الجدول الدوري، والعناصر اللامعدنية (عناصر كهرسلبية) الموجودة الى أقصى يمين الجدول الدوري.
تنشأ الرابطة التكافؤية من تشارك بالالكترونات، كما في حالة تشكل جزيء الهيدروجين على سبيل المثال. تملك كل ذرة هيدروجين الكتروناتً وحيداً؛ تكمل كلاهما الطبقة الالكترونية الخارجية الى الكترونين اثنين بعملية تشارك الكترونية. كذلك بالنسبة لذرتي فلور منها سبعة الكترونات في الطبقة الخارجية، تستطيع بلوغ الثمانية الالكترونية
بالتشارك في زوج من الالكترونات وبنفس الطريقة يمكننا ايضاح تشكل HF و H2O و HN3 و CH4 و CF4. وهنا أيضاً، تكون قوة الترابط قوة تجاذب كهرساكن، لكن هذه المرة بين كل من الالكترونين ولكلتي النواتين.
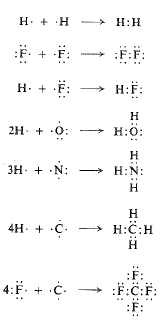
ان الرابطة المشتركة نوعية لمركبات الكربون وتكون الرابطة ذات الأهمية الرئيسة في الكيمياء العضوية.
مسألة: 1.1_ أي المركبات التالية تتوقع أن يكون أيوناً وأيها غير أيوني؟ اعطِ بنية الكترونية بسيطة لكل منها، مظهراً فقط، الكترونات طبقة التكافؤ.
(أ) KBr
(ب) H2S
(جـ) NF3
(د) CHCl3
(هـ) CaSO4
(و) NH4C1
(ز) PH3
(حـ) CH3OH
مسألة 2.1 اعطِ بنية الكترونية بسيطة محتملة لكل مما يلي، مفترضاً أنها تكافؤية بشكل تام. افترض أن كل ذرة (طبعاً ما عدا الهيدروجين) تملك ثمانية الكترونية، وأنه يمكن لذرتين أن تشارك بأكثر من شفع الكتروني.
(أ) H2O2
(ب) N2
(جـ) HONO2
(د) NO3-
(هـ) HCN
(و) CO2
(ز) H2CO3
(حـ) C2H6
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


