

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
تصنيع الالمنيوم
المؤلف:
GEORGE T . AUSTIN
المصدر:
SHREV ‘ S CHEMICAL PROCESS INDUSTRIES
الجزء والصفحة:
ص 422
20-9-2016
4647
تصنيع الالمنيوم
يجري إنتاج الألمنيوم المعدني بإرجاع الألومينا النقية الكتروليتياً في مغطس من الكرايوليت المنصهر . ومن أجل الألومينا النقية ، لا يمكن إرجاع الألومينا نظراً لتشكل Al2C3 ولأنه يحدث تفاعلاً عكسياً بين بخار الألمنيوم و CO2 في المكثف ويشكل بسرعة اكسيد الالمنيوم الأصلي من جديد الجدول 1-1 توزيع الاستخدام النهائي للألومونيوم في الولايات المتحدة (آلاف الأطنان المترية)
|
الاستخدام النهائي |
1966 |
1971 |
1978 |
% |
|
المباني والانشاءات |
902 |
1258 |
1292 |
24 |
|
النقل |
887 |
814 |
1242 |
22 |
|
الحاويات والتغليف |
336 |
688 |
1264 |
23 |
|
الاستخدامات الكهربائية |
591 |
649 |
594 |
11 |
|
المواد الاستهلاكية المتينة |
414 |
440 |
462 |
8 |
|
الآلات والمعدات |
297 |
292 |
395 |
7 |
|
السلع المصدرة |
265 |
258 |
غير متوفر |
|
|
أخرى |
413 |
331 |
247 |
4 |
|
الإجمالي |
4105 |
4730 |
5496 |
99 |
ويحصل تغير المحتوى الحراري enthalpy حسب التفاعل :
Al2O3 + 1. ½ C →2Al + 1. ½ CO2 Δ H = 1100 KJ at 1000 °C
مكافئاً لـ MJ 20.3 من الطاقة في الكغ من الألمنيوم المنتج . من الناحية العملية تستخدم بعض الطاقة لرفع حرارة المتفاعلات reactants ويفقد بعضها في الحرارة المسحوسة للنواتج . يشكل بعضاً من أول أكسيد الكربون في التفاعل فيزداد بذلك DH الإيجابي ، الذي يرتفع عملياً الى MJ / Kg 71.4-47.5 . وهكذا لا يمكن تصنيع هذا المعدن على نحو اقتصادي مالم تتوفر الطاقة الكهربائية بأسعار منخفضة . يأتي كربون الإرجاع من الأنود ، هذا الإرجاع الذي يحتاج من0.6-0.5 Kg من الكربون لكل كيلوغرام من المعدن . ومع أن الكمية النظرية اللازمة في المعادلة هي 0.33 كغ ، فإن ثاني أكسيد الكربون المنبعث يحتوي على 50-10 % من أول أكسيد الكربون ، ولذلك نحتاج الى المزيد في التطبيق العملي .
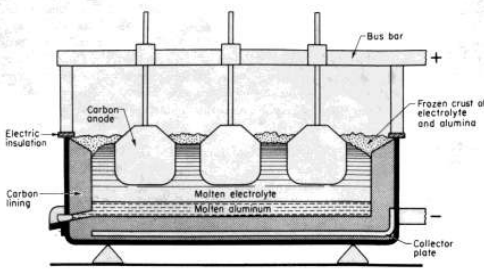
الصورة 1-1 رسم لمقطع عرضي في بوتقة لإنتاج الألمنيوم .
تتضمن (الصور من 1-1 الى 1-3) الطرق التي يشتمل عليها إنتاج معدن الألمنيوم .
- تركب بطانة الخلية أو تستبدل .
- يتم تصنيع أنودات الكربون وتستخدم في الخلية .
- يحضّر مغطس الكرايوليت ويضبط التركيب .
- تحل الألومينا في مغطس الكرايوليت المنصهر .
- يحل كهربائياً محلول الألومينا في الكرايوليت المنصهر لتشكيل معدن الألمنيوم ، الذي يقوم بدور الكاثود .
- يؤكسد إلكترود الكربون بالأكسجين المنطلق .
- يصرف الألمنيوم المنصهر من الخلايا ، ويخلط (عند الحاجة) ويصب الى كتل ويبرّد .
الخلايا الألكتروليتية عبارة عن حاويات فولاذية صندوقية ضخمة . في داخل كل منها حجيرة كاثودية مبطنة بمزيج مدكوك من القار وفحم الأنثراسيت أو الكوك المحمص في الموضع المناسب بمرور تيار كهربائي ، أو بلوكات كاثودية محمصة سلفاً ملتصقة مع بعضها . قد يكون تجويف الحجيرة الكاثودية من 30-50 سم عمقاً و 3 م عرضاً و 9 م طولاً اعتماداً على نموذج الخلية والحمل الذي صممت من أجله . وتتراوح ثخانة بطانة التجويف من 15-25 سم على الجوانب الى 26-46 سم في القاع . توضع مادة العزل الحراري التي تتألف من الطوب الحراري ، أو بلوكات الأسبستوس ، أو مواد أخرى مشابهة بين بطانة التجويف والخلية الفولاذية . تطمر قضبان فولاذية كبيرة ، تعمل كمجمعات لتيار الكاثود ، في الجزء الأسفل من بطانة التجويف وتمتد خارجة عبر فتحات في الغلاف لترتبط مع موصل الكاثود .
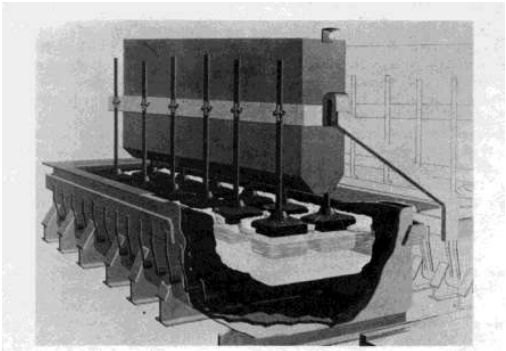
الصورة 1-2 . بوتقة إرجاع الألمنيوم ، تظهر الأجزاء الحقيقية التي رسمت في الصورة 1-1 مع قادوس الألومينا بين أنودات الكربون .
تخدم بطانة الخلايا في الحالة الطبيعية لمدة تصل الى 2 - 4 سنوات . وعندما محدث عطل ناتج عن اختراق المعدن لمجمعات الكاثود التي تحل ، او لنفوذ المعدن خارجاً الى الغلاف الفولاذي حيث يتسرب حول المجمعات . وعندئذ يجري استبدال كامل البطانة والمادة العازلة والمجمع. وكلفة اعادة بطانة الخلية جزء لا يستهان به من كلفة الانتاج متضمنة لس فقط كلفة العمل ، ومواد المجمعات ، والبطانة ، والعزل ، بل ايضاً خسارة المواد الالكتروليتية التي تمتصها البطانة المستهلكة (يسترد المنتجون اليوم على الأقل بعضاً من هذه المواد الإلكروليتية) .
يستخدم في طريقة هول - هيرولت Heroult – Hall نموذجان من الخلايا : الخلايا ذات الأنودات المتعددة المحمصة مسبقاً (الصورتان 1 - 1 و1 - 2) ، والخلايا ذات الأنود المحمص ذاتياً ، او انود سودربيرغ . وفي كلا النموذجين تعلق الأنودات من هيكل علوي يمتد عبر تجويف الخلية ويربط بموصل انود متحرك بحيث يمكن تعديل وضعها العمودي . يجري تصنيع بلوكات الانودات المحمصة مسبقاً من مزيج الكوك والقار او قطران البترول المكلس منخفض الرماد ، والذى يتشكل في مكابس هيدرولية ، ويحمص عند درجة حتى 100 مئوية .
تحمل خلايا انودات سودربيرغ ( الصورة 1 - 3 ) انوداً كبيراً مفرداً يمتد تحت كامل تجويف الخلية . يستقر الأنود في غلاف فولاذي مفتوح ذي جوانب عمودية تتم من خلالها التغذية نزولا الى الالكتروليت . وعندما يجري تشغيل الخلايا لأول مرة ، تسخن الى درجة حرارة التشغيل عن طريق التسخين بالمقاومة الكهربائية ، حيث توضع الانودات على تماس مع طبقة من جسيمات الكوك في قاع تجويف الخلية ويمر التيار عبر الخلية بدارة مقصرة Short Circuit وصولاً الى درجة الحرارة المرغوبة . تضاف المواد الالكتروليتية الى تجويف الخلية حول الانودات ، وبما ان هذه المواد تنصهر تدريجيا ، فان الانودات ترفع لتشغيل الخلية . في الحالة الطبيعية ، يبعد الأنود عن الكاثود حوالي 5 سم .
يتألف الإلكتروليت المنصهر بصورة رئيسية من الكرايوليت ( AlF3.3NaF اضافة الى زيادة ما من AlF3 و 6 - 10 % وزنا من CaF2 و 2 - 5 % من Al2O3 . بصدر بعض الكرايوليت من غرينلند ، مع انه في معظمه ينتج تركيبيا . ينتج و AlF3 ايضا تركيبيا من فلوريد الهيدروجين وهيدروكسيد الالمنيوم .
ان ضبط تركيب الالكتروليت عملية مهمة في المعالجة لإنتاج الالمنيوم . فعندما تكون درجة حرارة الانصهار الكرايوليت النقي 1009 مئوية ، فان الالكتروليت الذي يحتوي على الفلورسبار (CaF2) وزيادة ما من AlF3 ، مع الالومينا المصهورة يخفض ، درجة حرارة الانصهار بما يسمح للخلايا بالعمل عند 940 - 980 مئوية . وترتفع كفائة الخلايا ايضا عند زيادة AlF3 . تبلغ نسبة وزن NaF/AlF3 في الكرايوليت 1.50 ، وتعدل زيادة و AlF3 في الالكتروليت لتكون نسبة NaF/AlF2 ضمن المجال 1.10-1.40 .
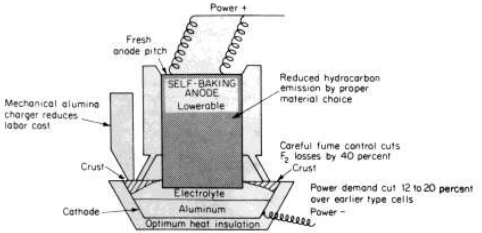
الصورة 1-3 . تعديل سوميتومو Sumitomo لخلية سودربيرغ . استهلاك الطاقة MJ 50.4 لكل طن متري من الألمنيوم .
في الاسابيع الاولى بعد تشغيل الخلية المبطنة حديثا ، يمتص الالكتروليت بسرعة الى البطانة والمادة العازلة ، مع تفضيل مميز لامتصاص الجزء ذي المحتوى الاعلى من الصوديوم ، وميل لتخفيض نسبة NaF/AlF3 الى ادنى من النسبة المرغوبة . وبعوض عن هذا بإضافة مادة قلوية كرماد الصودا .
3Na2CO3 + 4AlF3 → 2(3NaF.AlF3) + Al2O3 + 3CO3
بعد الاسابيع الاولى من تشغيل الخلايا ، يميل الإلكتروليت لان يستنفذ من AlF3 عن طريق تطاير المركبات الغنية بـ AlF3 ومن خلال التفاعل مع ثمالة الصودا الكاوية الموجودة في الالومينا والحلمأة من الهواء او المواد المضافة :
3Na2O + 4AlF3 → 2(3NaF.AlF3) + Al2O3
3H2O + 2AlF3 → Al2O3 + 6HF
تجمع الفلوريدات الطيارة وفلوريد الهيدروجين الغازي، مع الغازات الاخرى المنبعثة من الخلايا ، بواسطة اغطية او مواسير لجمع الغاز وتمرر عبر قنوات كبيرة الى المعالجة المركزية للغاز وتجهيزات الاسترجاع .
تستعيد اجهزة غسل الغاز على الناشف الجسيمات المادية وتفاعل HF مع Al2O3 ، الذي يغذى عندئذ الى الخلية . يجب ان تكون الاستعادة فعالة جدا ، لان وجود الفلوريدات بكميات بسيطة في الجو يلحق ضرراً شديداً بالنباتات . تستلزم الخسارة التي تلحق بالالكتروليت اضافات دورية من AlF3 للمحافظة على التركيب المرغوب . تكفي النسبة البسيطة من الجير ، الموجودة في الحالة الطبسية على شكل شائبة في الالومينا ، للمحافظة على الفلورسبار بالتركيز المرغوب من خلال التفاعل التالي .
3CaO + 2AlF3 → 3CaF2 + Al2 O3
تتشكل اثناء تشغيل الخلية ، قشرة متجمدة على سطح المغطس المنصهر .
تضاف الالومينا فوق هذه القشرة ، حيث تسخن ويزال ماؤها الذي كانت قد امتصته آلياً . يجري تكسير القشرة دوريا ، وتمزج الألومينا بالتحريك في المغطس للمحافظة على تركيز 2 - 6 % . ويلزم نظريا 89.1 كغ من الالومينا لكل كيلوغرام من الألمنيوم ، وفي التطبيق العملي ، يصل ذلك حتى 91.1 كغ . عندما تستنفذ الالومينا الموجودة في المغطس ، يحدث التأثير المعروف للأنود ـ حيث تتشكل عن طريقه طبقة رقيقة من رباعي فلوريد الكربون carbon tetraflouride على الأنود بحيث يتوقف المغطس عن تبليل سطح الأنود ، مما يسبب ارتفاعا مفاجئا في فولطية الخلية ، الذي يستدل عليه بواسطة مصباح او جرس اشارة متفرع عبر الخلية ولا يعمل ضمن الفولطية الطبيعية للخلية. وعندما يحدث هذا ، تمزج الالومينا في الخلية ، رغم عدم التزامن مع الاضافة الدورية الروتينية للألومينا ، وتعود المعالجة بالتحلل الكهربائي وفولطية الخلية الى الحالة الطبيعية . وما تزال غير مؤكدة الآلية الفعلية التي تذوب فيها الالومينا في مغطس الصهر وتتفكك الكتروليتياً . ينتج في النهاية اطلاق الاكسجين الى الأنود وترسب معدن الالمنيوم على الكاثود . ويشارك الاكسجين مع انود الكربون لإعطاء CO و CO2 ، بسيطرة. CO2 .
 الاكثر قراءة في مواضيع عامة في الكيمياء الصناعية
الاكثر قراءة في مواضيع عامة في الكيمياء الصناعية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















