علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
Axial and Equatorial Bonds in Cyclohexane
المؤلف:
John McMurry
المصدر:
Organic Chemistry
الجزء والصفحة:
9th ed - p104
19-9-2016
3858
Conformations of Monosubstituted Cyclohexanes
Even though cyclohexane rings flip rapidly between chair conformations at room temperature, the two conformations of a monosubstituted cyclohexane aren’t equally stable. In methylcyclohexane, for instance, the equatorial conformation is more stable than the axial conformation by 7.6 kJ/mol (1.8 kcal/mol).
The same is true of other monosubstituted cyclohexanes: a substituent is almost always more stable in an equatorial position than in an axial position. You might recall from your general chemistry course that it’s possible to calculate the percentages of two isomers at equilibrium using the equation ΔE = - RT ln K, where DE is the energy difference between isomers, R is the gas constant [8.315 J/(K·mol)], T is the Kelvin temperature, and K is the equilibrium constant between isomers. For example, an energy difference of 7.6 kJ/mol means that about 95% of methylcyclohexane molecules have an equatorial methyl group at any given instant while only 5% have an axial methyl group. Figure 1-1 plots the relationship between energy and isomer percentages.
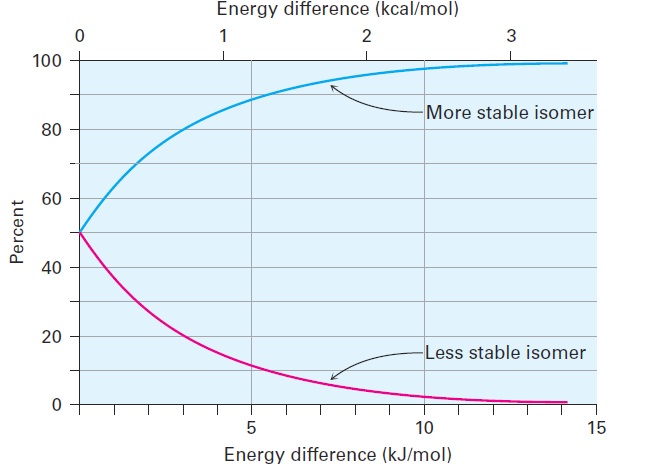
Figure 1-1 A plot of the percentages of two isomers at equilibrium versus the energy difference between them. The curves are calculated using the equation ΔE = - RT ln K.
The energy difference between axial and equatorial conformations is due to steric strain caused by 1,3-diaxial interactions. The axial methyl group on C1 is too close to the axial hydrogens three carbons away on C3 and C5, resulting in 7.6 kJ/mol of steric strain (Figure 1-2 ).
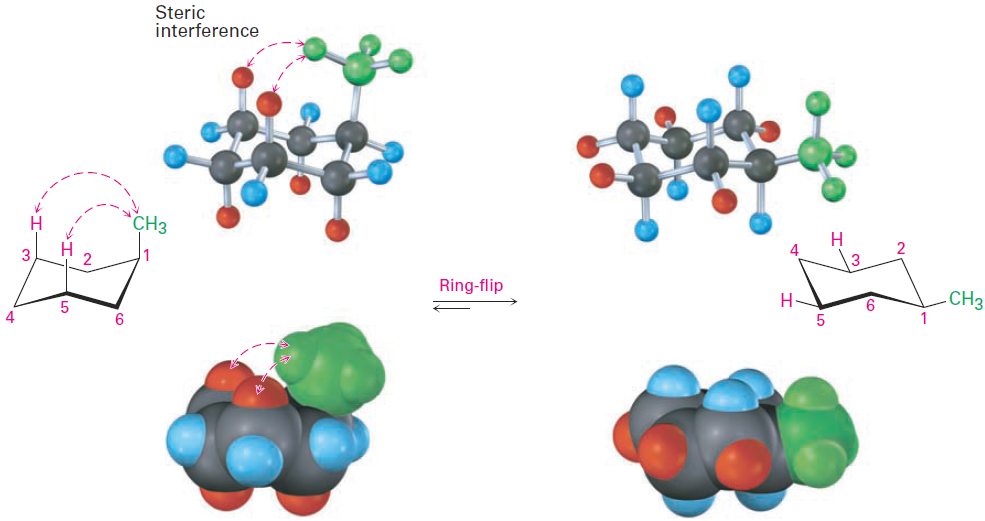
Figure 1-2 Interconversion of axial and equatorial methylcyclohexane, represented in several formats. The equatorial conformation is more stable than the axial conformation by 7.6 kJ/mol.
The 1,3-diaxial steric strain in substituted methylcyclohexane is already familiar—we saw it previously as the steric strain between methyl groups in gauche butane.
Comparing a four-carbon fragment of axial methylcyclohexane with gauche butane shows that the steric interaction is the same in both cases (Figure 1-3 ). Because axial methylcyclohexane has two such interactions, it has 2 x 3.8 = 7.6 kJ/mol of steric strain. Equatorial methylcyclohexane has no such interactions and is therefore more stable.

Figure 1-3 The origin of 1,3-diaxial interactions in methylcyclohexane. The steric strain between an axial methyl group and an axial hydrogen atom three carbons away is identical to the steric strain in gauche butane. Note that the - CH3 group in methylcyclohexane moves slightly away from a true axial position to minimize the strain. (To clearly display the diaxial interactions in methylcyclohexane, two of the equatorial hydrogens are not shown.)
The exact amount of 1,3-diaxial steric strain in a given substituted cyclohexane depends on the nature and size of the substituent, as indicated in Table 1-1. Not surprisingly, the amount of steric strain increases through the series H3C- < , CH3CH2- < , (CH3)2CH - << ,, (CH3)3C -<< , paralleling the increasing size of the alkyl groups. Note that the values in Table 1-1 refer to 1,3-diaxial interactions of the substituent with a single hydrogen atom. These values must be doubled to arrive at the amount of strain in a monosubstituted cyclohexane.
Table 1-1 Steric Strain in Monosubstituted Cyclohexanes

 الاكثر قراءة في الهايدروكاربونات
الاكثر قراءة في الهايدروكاربونات
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)