
التصنيع مركبات المغنزيوم
 المؤلف:
GEORGE T . AUSTIN
المؤلف:
GEORGE T . AUSTIN
 المصدر:
SHREV ‘ S CHEMICAL PROCESS INDUSTRIES
المصدر:
SHREV ‘ S CHEMICAL PROCESS INDUSTRIES
 الجزء والصفحة:
ص 325
الجزء والصفحة:
ص 325
 31-8-2016
31-8-2016
 2053
2053
التصنيع مركبات المغنزيوم :
نجح تصنيع مركبات المغنزيوم في ألمانيا منذ زمن طويل . وبنتيجة الدراسات الشاملة ، الفيزيائية والكيميائية ، قام الاتحاد الدولي للمناجم والكيمياء بتصنيع كلوريد المغنزيوم من اللنغبينيت langbeinite المتبلور من الكارناليت Carnallite KCl.MgCl2.6H2O . يتحلل هذا الملح المضاعف فينتج كلوريد المغنزيوم .
يمكن تقسيم انتاج مركبات المغنزيوم عن طريق فصلها من المحاليل الملحية الى اربع عمليات :
1- تصنيعها من مياه البحر بدون تبخير ، باستخدام هذه المياه والجير كمادتين خام رئيسيتين . تقوم بذلك شركتا Dow و Merck ، حيث تصنعان هيدرات المغنزيوم التي تحل بحمض كلور الماء 10 % لإنتاج محلول كلور المغنزيوم . ثم يركز كلور المغنزيوم في اجهزة تبخير ، تليها اجهزة تجفيف ، فتنتج كلوريد مغنزيوم 76 % جاهزاً لنقله الى خلايا ألكتروليتية لصنع المغنزيوم المعدني.
2- تصنيعها من المياه المرة او من السوائل الأم من التبخير الشمسي لمياه البحر التي يستخرج منها الملح .
3- تصنيعها من الدولوميت ومياه البحر .
4- تصنيعها من مياه الابار الملحية العميقة . واظهرت لاه المياه بالتحليل في ميتشغن زيادة في الانتاج كما يلي : 20.7 % من 2CaCl ، و 3.9 % من 2MgCl و 5.73 % من NaCl . تحرر الكميات الصغيرة من البروم بواسطة الكلور ، وبعد ازالتها يُرسب Mg(OH)2 بواسطة الدوليم النقي المطفأ (الدولوميت المكلس) . ثم يرشح ، وبغسل لتأمين الروبة تحتوي على 45 % من Mg(OH)2 بنقاوة عالية تكس هذه الروبة عند درجة حرارة عالية لانتاج البيركلاز periclase ، وهو عقدة MgO الملبدة التي تستخدم في صنع الاجر الصامد للصهر .
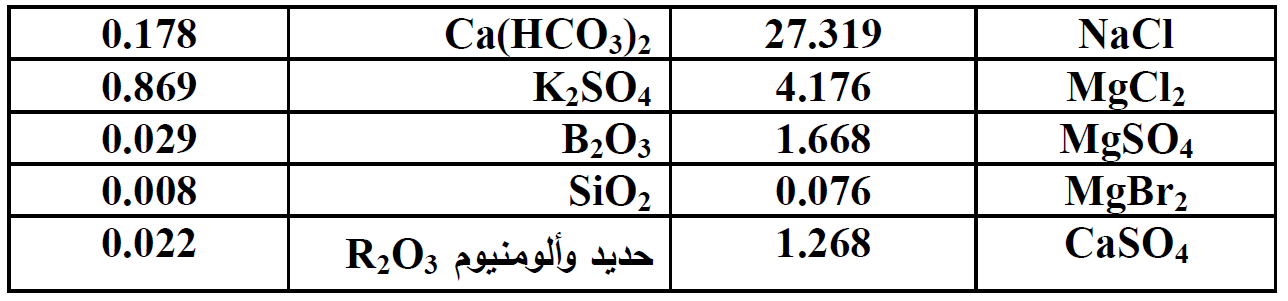
يتضمن الجدول 1 - 1ادناه تحليلاً نموذجياً لمياه البحر . يصبح انتاج مركبات المغنزيوم من مياه البحر ممكناً بفضل الانحلال المعدوم تقريباً لهيدروكسيد المغنزيوم في الماء . ويعتمد النجاح في الحصول على هذه المركبات بهذه الطريقة على:
1- وسائل رخيصة لتيسير الماء بالجير أو بالدولوميت المكلس .
2- تحضير روبة الجير النقي أو الدولوميت المكلس بمواصفات مناسبة .
3- ازالة الهيدروكسيد المترسب من الحجم الكبير للماء المستخدم بكلفة اقتصادية .
4- تنقية الرواسب المائية بكلفة بسيطة .
5- تطوير وسائل لترشيح الطين السائل .
وهذه هي التفاعلات :
 DH = 13.3 kJ
DH = 13.3 kJ
تظهر الصورة 1 - 1 مخططا لإنتاج منتجات المغنزيوم من مياه البحر . وتمثل الصورة 2 - 1 مخططا لإنتاج المواد الكيميائية الناعمة والمستحضرات الصيدلانية كحليب المغنسيا وعدة كربونات مغنزيومية اساسية مثل 3MgCO3.Mg(OH)2.4H2O من اجل مساحيق الأسنان والعلاجات المضادة للحموضة ، وتغليف ملح المائدة للحيلولة دون تجبله ، ولحشوات الدهان . وتستخدم بعض من هذه المركبات ايضا مع مسرعات المطاط . وحيثما يستخدم الدولوميت المكلس بدلا من كربونات الكلسيوم ، يجب ان يأتي فقط حوالي نصف المغنسيا من املاح المغنزيوم في مياه البحر* . وهكذا يكون حجم المصنع اصغر وقد تكون كلفة الناتج اقل .

صورة 1.2 : مركبات المغنزيوم المنقاة من مياه البحرفي جنوب سان فرانسسكو
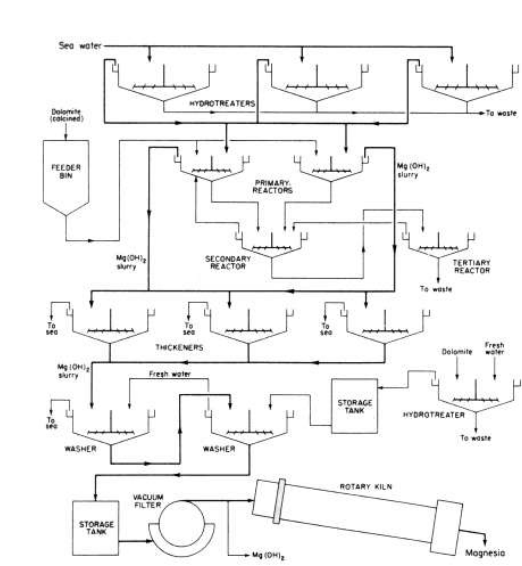
صورة 1.1 : مخطط لانتاج 2(Mg(OH) منمياه البحر والدولومايت .
* تحمل مياه البحر بصورة طبيعية 2.2 غ / ل مما يكافئ MgO ، الذي يوجد عمليا بشكل MgCl2 و 2MgSO . وبالتالي نحتاج نظرياً الى 375 م3 من مياه البحر لإنتاج طن من MgO وعلى اساس حصيلة بنسبة 70 % ، يجب ان يضخ 538 م3 للحصول على كل المغنسيا من مياه البحر ، او حوالي نصف هذه الكمية عند استخدم الدولوميت .
يمكن تكليس Mg(OH)2 عند 700 مئوية لتنشيط MgO الكيميائي ، أو عند درجة تتراوح من 1475-1650 مئوية تقريباً لـ periclase MgO . يختلف Mg(OH)2 هذا تماما عن Mg(OH)2 المرسب ببطء بواسطة القلويات النحلة أو بلبن الجير وفيما يلي التفاعلات الظاهرة في الصورتين 2 - 1 و 1 - 1 :
يلزم لتيسر مياه البحر الى 7 % فقط من الدولوميت المكلس المطفأ ، ويستخدم الباقي لترسيب Mg(OH)2 البلوري ، الذى يرشح ، ويغسل . ومحول هذا الهيدروكسيد الى نواتج اخرى .
الجدول 1-1. تركيب مياه البحر ( عدد الغرامات بالليتر ، الوزن النوعي 1.042)
 الاكثر قراءة في مواضيع عامة في الكيمياء الصناعية
الاكثر قراءة في مواضيع عامة في الكيمياء الصناعية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


