
تاريخ الفيزياء

علماء الفيزياء


الفيزياء الكلاسيكية

الميكانيك

الديناميكا الحرارية


الكهربائية والمغناطيسية

الكهربائية

المغناطيسية

الكهرومغناطيسية


علم البصريات

تاريخ علم البصريات

الضوء

مواضيع عامة في علم البصريات

الصوت


الفيزياء الحديثة


النظرية النسبية

النظرية النسبية الخاصة

النظرية النسبية العامة

مواضيع عامة في النظرية النسبية

ميكانيكا الكم

الفيزياء الذرية

الفيزياء الجزيئية


الفيزياء النووية

مواضيع عامة في الفيزياء النووية

النشاط الاشعاعي


فيزياء الحالة الصلبة

الموصلات

أشباه الموصلات

العوازل

مواضيع عامة في الفيزياء الصلبة

فيزياء الجوامد


الليزر

أنواع الليزر

بعض تطبيقات الليزر

مواضيع عامة في الليزر


علم الفلك

تاريخ وعلماء علم الفلك

الثقوب السوداء


المجموعة الشمسية

الشمس

كوكب عطارد

كوكب الزهرة

كوكب الأرض

كوكب المريخ

كوكب المشتري

كوكب زحل

كوكب أورانوس

كوكب نبتون

كوكب بلوتو

القمر

كواكب ومواضيع اخرى

مواضيع عامة في علم الفلك

النجوم

البلازما

الألكترونيات

خواص المادة


الطاقة البديلة

الطاقة الشمسية

مواضيع عامة في الطاقة البديلة

المد والجزر

فيزياء الجسيمات


الفيزياء والعلوم الأخرى

الفيزياء الكيميائية

الفيزياء الرياضية

الفيزياء الحيوية

الفيزياء العامة


مواضيع عامة في الفيزياء

تجارب فيزيائية

مصطلحات وتعاريف فيزيائية

وحدات القياس الفيزيائية

طرائف الفيزياء

مواضيع اخرى
القانون الأول للديناميكا الحرارية
المؤلف:
فريدريك بوش ، دافيد جيرد
المصدر:
اساسيات الفيزياء
الجزء والصفحة:
ص 439
30-6-2016
2494
القانون الأول للديناميكا الحرارية
كان الباحثون القدامى في مجال الديناميكا الحرارية أول من توصل إلى فكرة بقاء الطاقة. وبعد أن تمكن هؤلاء العلماء من إثبات أن الحرارة صورة من صور الطاقة، أصبح من الضروري أن تؤخذ الحرارة في الاعتبار عند إعداد "حساب الأرباح والخسائل" في الطاقة ؛ وبهذه الطريقة أمكنهم التوصل إلى علاقة اساسية هامة بين الحرارة والشغل والطاقة الداخلية. لنتعرف الآن على هذه العلاقة.
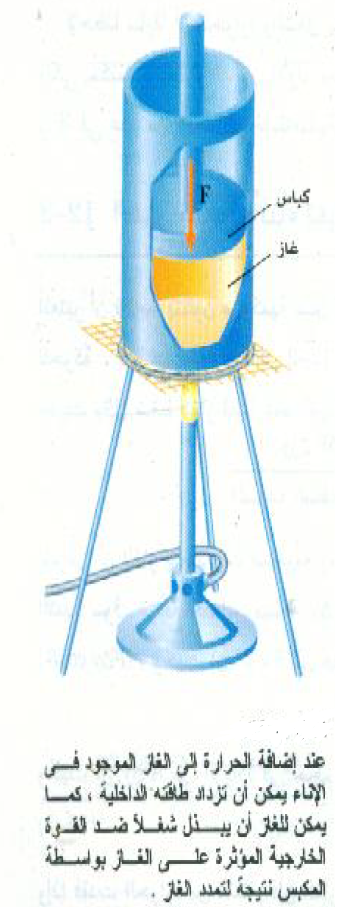
لكل نظام في حالة معينة كمية محدودة من الطاقة الداخلية ، وإننا نتساءل الآن عما يحدث للنظام عندما تنساب إليه كمية من الحرارة. هذه الطاقة المضافة يمكن أن تستعمل بطريقتين: (1) زيادة الطاقة الداخلية للنظام، أو (2) إمداد النظام بالطاقة التي يحتاجها لكي يبذل كمية من الشغل w على الوسط المحيط به. فإذا أخذنا النظام الموضح بالشكل (1) والذي يمثل غازاً في أسطوانة فإننا سنجد أن الطاقة المضافة يمكنها أن تسبب تغيرين في النظام: (1) رفع درجة حرارة الغاز ومن ثم زيادة طاقته الداخلية، (2) تمدد الغاز مما يؤدي إلى رفع الكباس إلى أعلى مما يسمح للغاز بأن يبذل شغلاً على الكباس.
وإذا فحصنا أي نظام فإننا سنجد أن الطاقة المضافة إليه تستهلك دائماً بنفس هاتين الطرقتين، وهكذا يمكننا أن نستنتج أن:

الشكل (1)
وهذه الصيغة تسمى القانون الأول للديناميكا الحرارية، والذي يمكن كتابته في صورة المعادلة:
Q = ΔU + W
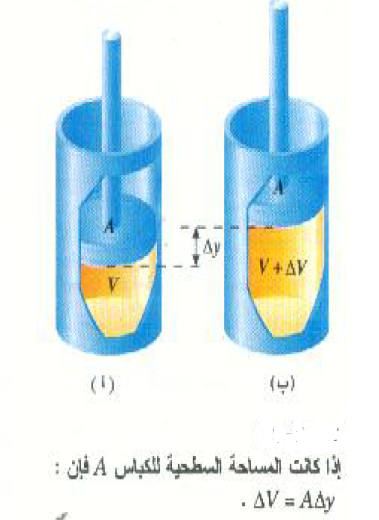
لاحظ أن القانون الأول هو صيغة خاصة لقانون بقاء الطاقة تتضمن الطاقة الداخلية. عند تطبيق الأول يجب مراعاة الحرص الشديد في اختيار الإشارات الصحيحة للكميات الداخلة فيه. فالكمية Q هي دائماً كمية الحرارة المنسابة إلى النظام ، أما إذا كانت الحرارة تنساب من النظام فإن Q تكون سالبة. كذلك فإن ΔU هي الزيادة في الطاقة الداخلية للنظام، بينما W يمثل الشغل المبذول بواسطة النظام. فإذا كان الغاز في الشكل 2)) يسبب ارتفاع الكباس إلى أعلى، فإن الغاز يبذل شغلاً خارجياً ويكون W موجباً. أما إذا دفع الكباس إلى أسفل بواسطة قوة خارجية فإن W سيكون سالباً لأن الغاز يبذل شغلاً سالباً. ولفهم هذه العبارة الأخيرة، تذكر أن:
cos θ × الازاحة × القوة = الشغل
الشكل 2))
حيث θ هي الزاوية بين متجه القوة ومتجه الإزاحة. ويلاحظ في الشكل ((1 أن القوة التي يؤثر بها الغاز على الكباس إلى أعلى تساوي F (بفرض أن الكباس يتحرك بسرعة ثابتة). وعندما يتحرك الكباس إلى أسفل مسافة قدرها sΔ فإن الشغل المبذول بواسطة الغاز سيكون:
W= F Δs cos 180o = -F Δs
إذن: عندما ينضغط الغاز يكون الشغل المبذول بواسطته سالباً.
لاحظنا ان الحرارة والشغل يعتمدان على الطريقة التي تتغير بها حالة الغاز. ولكي يمكننا استخدام القانون الأول يجب علينا الآن دراسة طرق حساب كل من Q و W في عدد من العمليات الديناميكية الحرارية.
 الاكثر قراءة في الديناميكا الحرارية
الاكثر قراءة في الديناميكا الحرارية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















