


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 2023-09-17
التاريخ: 2024-02-05
التاريخ: 2024-02-11
التاريخ: 16-2-2016
|
تجربة ( 7) معايرة خليط من حمض الكبريتيك وحمض الفوسفوريك
معايرة خليط من حمض الكبريتيك وحمض الفوسفوريك بواسطة محلول قياسي قاعدي من هيدروكسيد البوتاسيوم (0.15 مولاري).
الهدف من التجربة:
تعيين مولارية كلاً من حمض البكرتيتك و حمض الفوسفوريك والتركيز بالجرام/ لتر والوحدات الاخرى وتتم المعايرة بأستخدام دليلين (دليل الفينول فثالين ودليل الميثيل البرتقالي)وهذه المعايرة تتم على مرحلتين
المرحلة الأولى (في حالة أستخدام دليل الفينول نفثالين)
المرحلة الثانية (في حالة أستخدام دليل الميثيل البرتقالي)
المرحلة الأولى:عند استخدام دليل الفينول فثالين نجد أن حجم هيدروكسيد البوتاسيوم المستهلك من السحاحة يكافئ كل الكبريتيك وثلثي الفوسفوريك ومعادلات التفاعل توضح ذلك
H2SO4 +2KOH→K2SO4 +2H2O
من المعادلة نجد أن حمض الكبريتيك يتأين في خطوة واحدة لأنه حمض قوي بالرغم من وجود بروتونين
بذلك نجد أن هذا الحمض في المعايرة يعطي نقطة نهاية واحدة لأن يتأين البروتون الأول تماماً (أي تأين تام) ويتبع ذلك تأين للبروتون الثاني تأين تام لأنه يعتبر بروتون حمض قوي أيضا .
نجد أن حمض الفوسفوريك يتفكك في هذه المرحلة في خطوتين حيث يتأين البروتون الأولى ليعطي ملح فوسفات أحادي البوتاسيوم ثنائي الهيدروجين تم يتبع ذلك تأين البروتون الثاني ليعطي ملح فوسفات ثنائي البوتاسيوم أحادي الهيدروجين وهذا يمثل ثلثي الحمض والذي تظهره المرحلة الأولى عند استخدام دليل الفينول فثالين.
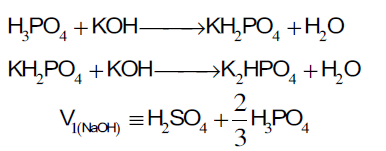

المرحلة الثانية :
عند استخدام دليل الميثيل البرتقالي نجد أن حجم هيدروكسيد البوتاسيوم المستهلك من السحاحة يكافئ كل الكبريتيك وثلث الفوسفوريك ومعادلات التفاعل في هذه المرحلة توضح ذلك:
H2SO4 +2KOH→K2SO4 +2H2O
حمض الكبريتيك في هذه الخطوة أيضاً يتأين في خطوة واحدة كما في المرحلة الأولى في هذه المرحلة نجد أن يحدث تأين لبروتون واحد من بروتونات الحمض فقط ليعطي ملح فوسفات ثنائي الهيدروجين أحادي البوتاسيوم وهذه يظهر تأين ثلث الحمض فقط في هذه المرحلة
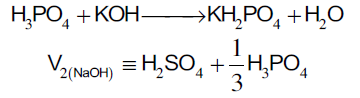

المواد والأدوات المطلوبة:
محلول من حمض الكبريتيك وحمض الفوسفوريك مجهول التركيز .
محلول قياسي من هيدروكسيد البوتاسيوم (0.15 M)
دليل الفينول نفثالين ودليل الميثيل البرتقالي .
السحاحة حامل السحاحة ودورق المعايرة (دورق المخروطي) ساق زجاجية ماصة سعة 20 مل ماصة سعة 25 مل ساق زجاجية كأس سعة400 مل
خطوات التجربة:
نظف أدوات التجربة جيداً بالماء المقطر ويتم غسل السحاحة بقليل من محلول هيدوكسيد البوتاسيوم.
بعد تنظيف السحاحة إملاء السحاحة بمحلول هيدروكسيد البوتاسيوم القياسي واضبط المحلول على صفر التدريج . وتأكد من عدم وجود فقاعات هوائية في السحاحة.
بالماصة خذ ( 25 مل) من محلول الخليط الحمضي في دورق المعايرة،تم أضف إلى الدورق المخروطي قطرتين من دليل الفينول نفثالين.
عاير محلول الخليط الحمضي بتنقيط محلول هيدروكسيد البوتاسيوم من السحاحة قطرة قطرة مع الرج المستمر حتى يتغير لون المحلول من عديم اللون إلى الأحمر وسجل الحجم المستهلك وليكن 1V وهو الحجم المستهلك للوصول إلى نقطة التكافؤ (نقطة النهاية)
نظف الدورق المخروطي بالماء المقطر جيداً تم بقليل من محلول الخليط الحمضي .
تم بواسطة الماصة اخذ 25 مل من محلول الخليط الحمضي في دورق المعايرة (دورق المخروطي) تم أضف قطرتين من دليل الميثيل البرتقالي .
أضبط محلول هيدروكسيد البوتاسيوم على صفر التدريج في السحاحة ، تم ابدأ بعملية المعايرة بتنقيط محلول هيدروكسيد البوتاسيوم القياسي قطرة قطرة مع الرج المستمر عقب كل قطرة واستمر في المعايرة حتى يتغير لون المحلول من الأحمر إلى الأصفر وسجل الحجم المستهلك من السحاحة وليكن V2 وهو الحجم المستهلك للوصول إلى نقطة التكافؤ (نقطة النهاية).
أعد نفس الخطوات السابقة وسجل الحجم المستهلك في حالة كل دليل وليكن V3 في حالة دليل الفينول V4 في حالة دليل الميثيل البرتقالي .
الحسابات
حساب متوسط الحجم المستهلك في حالة دليلين
الحجم المستهلك في حالة دليل الفينول نفثالين


من معدلات التفاعل نجد أن 2 مول من هيدروكسيد البوتاسيوم تكافئ 1مول من حمض الكبريتيك و 3 مول من هيدروكسيد البوتاسيوم تكافئ 1مول من حمض الفوسفوريك،ولكي نستطيع حساب مولارية كلاً من الحمضين لابد أن يتساوى عدد مللي مولات الحمض مع عدد مللي مولات القاعدة.




ملاحظة:
في معايرات الحموضة والقلوية وعند استخدام المحاليل القياسية فإن عدد المولات (mol/L) بالتركيز المولاري الذي تعبرعنه معادلات التفاعل الموزونة مهم لأنه يدخل في عملية الحسابات لحساب مولارية المحلول المجهول وكما سبق وأوضحنا في معايرة خليط حمض الكبريتيك والفوسفوريك بواسطة محلول قياسي من هيدروكسيد البوتاسيوم.


|
|
|
|
دراسة يابانية لتقليل مخاطر أمراض المواليد منخفضي الوزن
|
|
|
|
|
|
|
اكتشاف أكبر مرجان في العالم قبالة سواحل جزر سليمان
|
|
|
|
|
|
|
اتحاد كليات الطب الملكية البريطانية يشيد بالمستوى العلمي لطلبة جامعة العميد وبيئتها التعليمية
|
|
|