

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
رذاذات التكاثف: كبريتات الأمونيوم (Condensation aerosols-ammonium sulfate)
المؤلف:
غاري و. فان لون , ستيفن ج. دفي
المصدر:
كيمياء البيئة نظرة شاملة
الجزء والصفحة:
ص 555-256
2023-12-24
1740
ثمة كثير من السيرورات الكيميائية المتنوعة التي تتضمن متفاعلات غازية يمكن أن تؤدي إلى تكاثف جسيمات معلقة سائلة أو صلبة في الجو. والمكونان الرئيسيان الناجمان عن تكاثف الرذاذات الآتية من اليابسة والبحر هما كبريتات هدروجين الأمونيوم (4NH4HSO) وكبريتات الأمونيوم (4NH4 )SO))، ويتولد كل من هذين الجنسين الصلبين نتيجة لسلسلتي تفاعل متوازيتين تبدأ السلسلة الأولى بصيغ كبريت عضوية مُرجَعة (حالة الأكسدة (2 من قبيل كبريتيد ثنائي الميثيل (CH) .
ووفقاً لما ناقشناه بالتفصيل في الفصل الخامس، تحول تفاعلات الأكسدة، التي يعمل فيها الأكسجين وجذر الهدروكسيل عوامل أكسدة ، الغازات المُرجَعة المحتوية على الكبريت إلى ثاني أكسيد الكبريت. ويخضع ثاني أكسيد الكبريت هذا، المعزز بكميات إضافية تتحرر مباشرة من مصادر أخرى معظمها صناعي، إلى مزيد من الأكسدة لتكوين حمض الكبريت.
وفي نفس الوقت، تنطلق إلى الغلاف الجوي أمونيا من مصادر متعددة، طبيعية ومن صنع البشر، متيحة تكوين رذاذات كبريتات الأمونيوم الآنفة الذكر. في أثناء التفكك الجرثومي للكتلة الحيوية الميتة والمادة العضوية في التربة والماء، تتفاعل مركبات نتروجينية من قبيل البروتينات مع الأمونيا لتحرر شوارد أمونيا/أمونيوم في الجو المحيط. وأحد المصادر الهامة للكتلة الحيوية الغنية بالنتروجين التي تخضع لهذه التفاعلات هو روث الحيوانات المجمع أو المنثور فوق التربة. عندما يوضع قطيع حيوانات كبير في مكان مغلق محدود المساحة، فإن ذلك سوف يؤدي إلى مشكلة. فأحد مركّبات النتروجين في بول الحيوانات هو اليوريا الذي يتفاعل مع الماء لإنتاج الأمونيا وثاني أكسيد الكربون:

وتعتمد نسبة النتروجين المتحرر على درجة الحرارة والرطوبة وتركيبة التربة وعامل الحموضة ، وعلى طبيعة النباتات التي تنمو حيث يوضع الروث. لكن على النطاق العالمي، فقد تصل نسبة النتروجين الذي يتطاير على شكل أمونيا من فضلات الحيوانات إلى 20%.
وعلى نحو مشابه، عندما تُستعمل أسمدة صنعية تحتوي على نتروجين مُرجع شوارد أمونيوم أو يوريا من الممكن أن تتحرر أجناس من الأمونيا تنشأ الأمونيا الغازية في بيئة قلوية، في حين أن شوارد الأمونيوم تُشجَّع في الظروف الحمضية أو المعتدلة. وتنحل شوارد الأمونيوم في محلول التربة المائي، وبافتراض أن قيمة عامل حموضة التربة ليست كبيرة جداً، تثبت في مواقع تبادل الشحنة الموجبة (الفصل الثامن عشر) و/أو تتأكسد لتتحول إلى نترات قبل أن تمتصها المزروعات.
يكون تطاير الأمونيا قليلاً إذا حصل تفكك المادة العضوية في تربة جيدة التهوية أو إذا كان السماد مخلوطاً بالتربة السطحية وامتصه النبات بكفاءة. من ناحية أخرى، حينما يُستعمل نفس هذا السماد في تربة مشبعة بالماء نتيجة لطوفان أو إغراق في أثناء تنمية الأرز ، تحافظ ظروف الإرجاع على النتروجين في صيغة الأمونيا/أمونيوم، وتبعاً لعامل حموضة محلول التربة، يمكن أن يحصل تطاير كبير للأمونيا.
وتتحرر أمونيا إضافية من عدد من السيرورات الصناعية أيضاً.
تتفاعل الأمونيا مع حمض الكبريت لتكوين كبريتات هدروجين الأمونيوم أو كبريتات الأمونيوم (التفاعلان 4.6 و 5.6) على شكل جسيمات تقع أقطارها ما بين 0.1 و 1 مكرون تقريباً. ونظراً إلى أن كمية حمض الكبريت تكون زائدة عادة، يكون المركب الأول هو المهيمن في معظم الحالات:
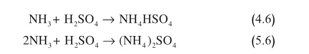
وتعمل جسيمات ملح الكبريتات الأليفة للماء بوصفها نوى يتكاثف الماء حولها لتكوين الغيم. وحيثما يكون ثمة تركيز عال من الجسيمات، تتألف الغيوم من عدد كبير من القطيرات البالغة الصغر. وهذه الغيوم أكثر ابيضاضاً وأشد عكساً للضوء من تلك التي تحتوي على عدد من أقل القطرات الكبيرة. وهذه واحدة من الطرائق التي تؤثّر بها الرذاذات الجوية في مقدرة الغيوم على عكس الضوء التي تعتبر منظماً هاماً للمناخ الأرضي.
وتتكون نترات الأمونيوم بطريقة مشابهة في تفاعل مماثل بين الأمونيا وحمض النتريك.
 الاكثر قراءة في كيمياء البيئة
الاكثر قراءة في كيمياء البيئة
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















