
الأكسجين المنحل (Dissolved Oxygen (DO
 المؤلف:
د. حسان صديق / د. نائل يسري
المؤلف:
د. حسان صديق / د. نائل يسري
 المصدر:
كيمياء البيئة
المصدر:
كيمياء البيئة
 الجزء والصفحة:
ص 218-219
الجزء والصفحة:
ص 218-219
 2023-10-29
2023-10-29
 2335
2335
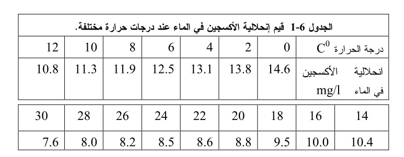
إن أهم مقياس لتحديد نوعية المياه هو قياس كمية الأكسجين المنحل. فعلى الرغم من ضعف قابلية الأكسجين للإنحلال في الماء، فإن وجوده يعتبر أمراً أساسياً في الحياة المائية. فبدون الأكسجين المنحل الحر، سنجد بأن الجداول والبحيرات ستصبح غير صالحة لحياة الكائنات المائية ذات التنفس الخيشومي. تتناسب كمية الأكسجين المنحل عكساً مع درجة الحرارة، ويمكن أن يصل الحد الأعلى لكمية الأكسجين التي يمكن حلها في الماء عند درجات حرارة الأكثر ملائمة حوالي 10 ملغ/ل. تتناقص قيمة الإشباع بسرعة مع زيادة درجة حرارة المياه، كما هو مبين في الجدول (6-1). لذلك فإن التوازن بين الإشباع وعدم الإشباع حساس جداً.
.يتم قياس كمية الأكسجين المنحل عادة إما بقياس كمية الأكسجين بطريقة كهركيميائية أو بالمعايرة اليودومترية تدعى الطريقة الثانية بطريقة وينكلر وتستخدم كمعيار لمقارنة جميع طرائق القياس الأخرى.
يعتمد مبدأ عملية القياس الكهر كيميائي على استخدام خلية غلفانية. فإذا وضع مسريين من الفضة والرصاص في محلول ناقل للتيار الكهربائي مع مقياس أمبيرومتري بينهما، فسوف يتم التفاعل التالي على مسرى الرصاص:
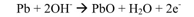
حيث تنتقل الإلكترونات المتحررة على مسرى الرصاص (المهبط) عبر المقياس الأمبيرومتري إلى مسرى الفضة (المصعد) حيث يحدث التفاعل التالي:
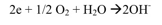
أما في حال عدم وجود أكسجين منحل حر فإن التفاعل السابق لن يتم ولن يسجل المقياس الأمبيرومتري مرور أي تيار كهربائي.
يتم تصميم المقياس ومعايرته بحيث أن كمية الكهرباء المسجلة تتناسب مع تركيز الأكسجين المنحل في المحلول في النماذج التجارية، تعزل الأقطاب الكهربائية عن بعضها البعض اسطة بو بوليمير غير منحل وتغطى بغشاء نصف نفوذ مع إضافة بضع قطرات من المحل الناقل بين الغشاء والأقطاب الكهربائية.
إذن يجب أن تتناسب كمية الأكسجين التي تنتقل عن طريق الغشاء نصف النفوذ مع تركيز الأكسجين المنحل. فعند تراكيز عالية من الأكسجين المنحل في المحلول سيتشكل دفع قوي عبر الغشاء نصف النفوذ، في حين أنه عند التراكيز المنخفضة فإن كمية قليلة فقط من الأكسجين ستمر عبر الغشاء، وبالتالي فإن التيار الكهربائي المتولد ينتج عن كمية جزيئات الأكسجين المسببة لحدوث التفاعل . أي أن التيار المتولد سيتناسب مع تركيز الأكسجين في المحلول.
 الاكثر قراءة في كيمياء البيئة
الاكثر قراءة في كيمياء البيئة
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


