
تهجين sp
 المؤلف:
الدكتور صلاح الدين محمود يونس
المؤلف:
الدكتور صلاح الدين محمود يونس
 المصدر:
الفيزياء الجزيئية
المصدر:
الفيزياء الجزيئية
 الجزء والصفحة:
128
الجزء والصفحة:
128
 6-1-2021
6-1-2021
 2291
2291
تهجين sp
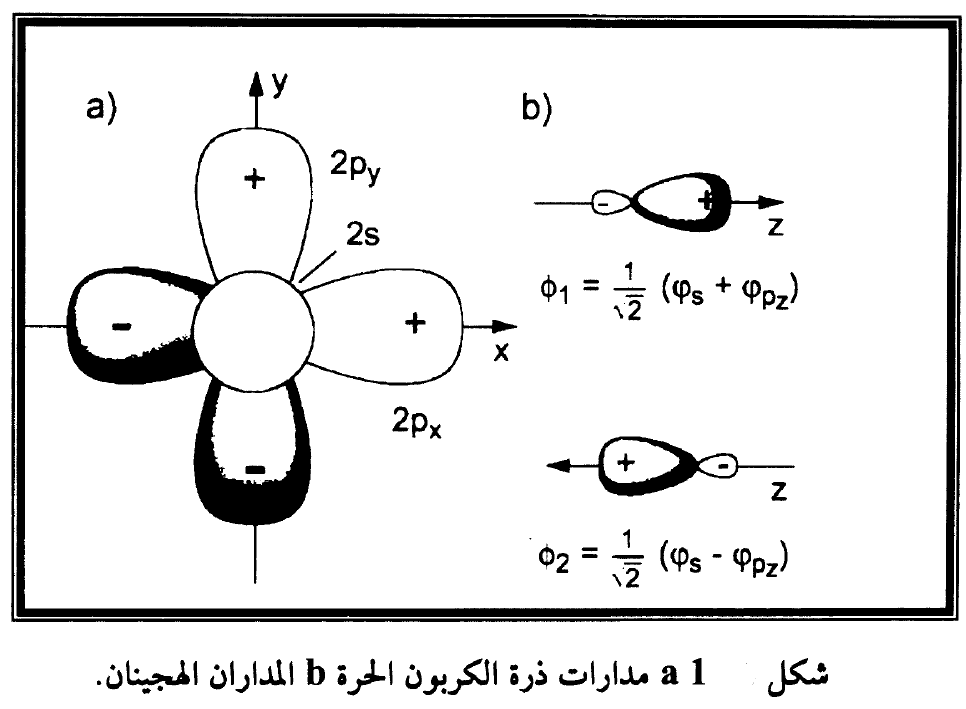
عند انشاء المدارات الجزيئية كجمع خطي للمدارات الذرية s وp فان النتيجة تدعى تهجين sp ويمكن توضيح هذه النتيجة لحالة ذرة الكربون التي في الحالة الارضية تملك الترتيب الالكتروني (2py) (2px) (2p2) (1s2) بالكترونين غير مزدوجين في المدار Px والمدار Py ولأن الالكترونات غير المزدوجة هي التي يمكن ان تشترك في التآصر فان هذا الترتيب الالكتروني يؤدي الى تكونين آصرتين تتجه ادحاهما باتجاه x والاخرى باتجاه y. فمثلا اذا تآصرت ذرتا هيدروجين مع ذرة كربون فان مدارات 1s ستمارس اكبر تداخل في اتجاه x واتجاه y ومقدار زاوية التآصر 90 ويبقى المدار Pz هو المتوفر فقط للتهجين.
نكتب المدارين الذريين الهجينين المتعامدين spz بالشكل:
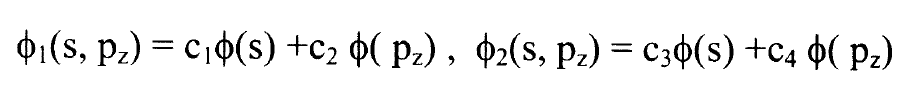 ..........(1)
..........(1)
من شرط المعايرة:
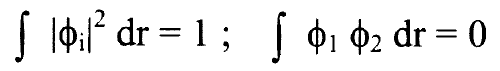 ...........(2)
...........(2)
نحصل على المكافئات Ci بتعويض (2) في (1):
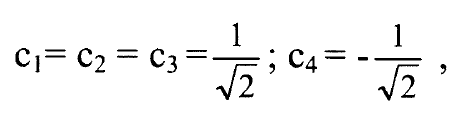
ويصبح المداران الذريان الهجينان بالصيغة:
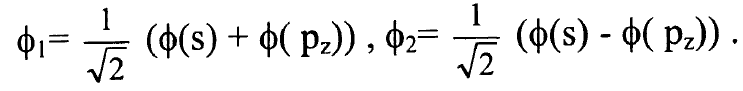 ...........(3)
...........(3)
اذا عوضنا دوال الهيدروجين الذرية (1) للدالة (Φ(s والدالة (Φ(Pz نحصل على الجزء الزاوي المعاير للمدارات الهجينة:
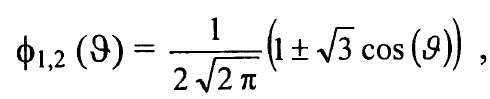 ..............(4)
..............(4)
حيث ϑ هي الزاوية باتجاه محور z ومن هذا يتبين ان 2|Φ1| تصل قيمتها العظمى عندما ϑ = 0 و2|Φ2| تصل قيمتها العظمى عندما ϑ = 180o لذا تحصل ذرة الكربون بالتهجين sp على آصرتين في الاتجاهين z ± بالمدارات الهجينة في المعادلة (3) كما مبين في شكل (1) حيث يقع هذان المداران الهجينان على خط مستقيم وبينهما زاوية 180o ويعاكسان بعضهما بالضبط من مركز ذرة الكربون.
 الاكثر قراءة في الفيزياء الجزيئية
الاكثر قراءة في الفيزياء الجزيئية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


