
What is a transition metal?
 المؤلف:
........
المؤلف:
........
 المصدر:
LibreTexts Project
المصدر:
LibreTexts Project
 الجزء والصفحة:
............
الجزء والصفحة:
............
 26-2-2019
26-2-2019
 2645
2645
What is a transition metal?
The terms transition metal (or element) and d block element are sometimes used as if they mean the same thing. They don't - there's a subtle difference between the two terms. We'll explore d block elements first:
You will remember that when you are building the Periodic Table and working out where to put the electrons using the Aufbau Principle, something odd happens after argon. At argon, the 3s and 3p levels are full, but rather than fill up the 3d levels next, the 4s level fills instead to give potassium and then calcium. Only after that do the 3d levels fill. The elements in the Periodic Table which correspond to the d levels filling are called d block elements. The first row of these is shown in the shortened form of the Periodic Table below.
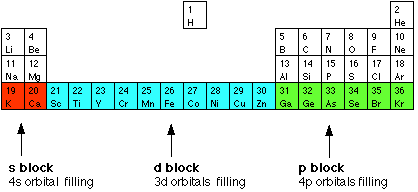
The electronic structures of the d block elements shown are:
| Sc |
[Ar] 3d14s2 |
| Ti |
[Ar] 3d24s2 |
| V |
[Ar] 3d34s2 |
| Cr |
[Ar] 3d54s1 |
| Mn |
[Ar] 3d54s2 |
| Fe |
[Ar] 3d64s2 |
| Co |
[Ar] 3d74s2 |
| Ni |
[Ar] 3d84s2 |
| Cu |
[Ar] 3d104s1 |
| Zn |
[Ar] 3d104s2 |
You will notice that the pattern of filling is not entirely tidy! It is broken at both chromium and copper.Transition metals
Not all d block elements count as transition metals!
A transition metal is one which forms one or more stable ions which have incompletely filled d orbitals. On the basis of this definition, scandium and zinc do not count as transition metals - even though they are members of the d block.
- Scandium has the electronic structure [Ar] 3d14s2. When it forms ions, it always loses the 3 outer electrons and ends up with an argon structure. The Sc3+ ion has no d electrons and so does not meet the definition.
- Zinc has the electronic structure [Ar] 3d104s2. When it forms ions, it always loses the two 4s electrons to give a 2+ ion with the electronic structure [Ar] 3d10. The zinc ion has full d levels and does not meet the definition either.
By contrast, copper, [Ar] 3d104s1, forms two ions. In the Cu+ ion the electronic structure is [Ar] 3d10. However, the more common Cu2+ ion has the structure [Ar] 3d9. Copper is definitely a transition metal because the Cu2+ ion has an incomplete d level.
 الاكثر قراءة في مواضيع عامة في الكيمياء اللاعضوية
الاكثر قراءة في مواضيع عامة في الكيمياء اللاعضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


