
تصبن خلات الايثيل في الوسط القلوي
 المؤلف:
الإدارة العامة لتصميم المناهج
المؤلف:
الإدارة العامة لتصميم المناهج
 المصدر:
أساسيات الكيمياء الفيزيائية (عملي)
المصدر:
أساسيات الكيمياء الفيزيائية (عملي)
 الجزء والصفحة:
ص25-26
الجزء والصفحة:
ص25-26
 2025-01-27
2025-01-27
 1173
1173
نظرية التجربة : تتميأ خلات الأيثيل في وسط قلوي تبعاً للمعادلة التالية:
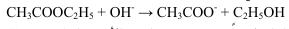
يتناسب معدل التفاعل طردياً مع تركيز كل من الأستر والقلوي، وبذلك فإن هذا التفاعل ينتمي إلى تفاعلات الرتبة الثانية، وإذا كان التركيز الابتدائي لكل من الأستر والقلوي متساوياً (a) فتكون المعادلة الحركية في هذه الحالة على الصورة:
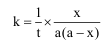
حيث K ثابت معدل سرعة التفاعل من الرتبة الثانية وX هي كمية المتفاعلة من الأستر أو القلوي بعد مرور الزمن t.
المواد المستخدمة:
1- خلات الأيثيل (M0.05)
2-هيدروكسيد الصوديوم (M0.05)
3-هيدروكسيد الصوديوم (M0.025)
4-حمض الهيدروكلوريك (M0.025).
5- دليل الفينول فيثالين
الأدوات المستخدمة :
1- سحاحة.
2- ماصة سعة 10مل.
3- مخبار مدرج سعة 50 مل.
4- دورق مخروطي.
خطوات العمل :
1- انقل في كأس نظيف و جاف بدقة 50مل من خلات الايثيل، وفي كأس آخر نظيف و جاف انقل 50 مل من NaOH ، واحفظ الكأسين عند 25مْ.
2- أضف محلول هيدروكسيد الصوديوم إلى الأستر بسرعة مع الرج و شغل ساعة الإيقاف لحظة الإضافة.
3- انقل بعد مرور 5 دقائق 10 مل من مخلوط التفاعل إلى دورق مخروطي يحتوي على 100مل ماء مقطر وبدقة 10مل من حمض (0.02) (الوقف التفاعل) وكذلك نقطة أو نقطتين من دليل الفينول فيثالين
4-عاير الزيادة من حمض HCI مع NaOH (0.025)
5- كرر الخطوتين السابقتين عندما يكون الزمن (30,25,20,15.10) دقيقة مع تسجيل حجم هيدروكسيد الصوديوم (X) مل.
الحسابات :
1. إذا كانت a هي كمية HCI المكافئ للتركيز الابتدائي لكل من القلوي والأستر فإن X هي كمية القلوي التي تكافئ الزيادة من HCl بعد زمن و (a-x) هي كمية الأستر أو القلوي المتبقية فيمكن تسجيل النتائج في الجدول التالي
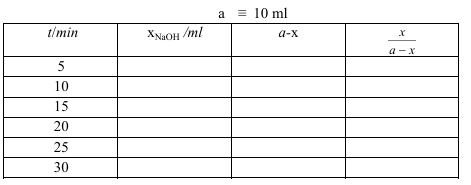
حيث 0.025 = a.
2- ارسم العلاقة بين 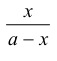 مقابل t تحصل على خط مستقيم : الميل = Xa K.
مقابل t تحصل على خط مستقيم : الميل = Xa K.
3- من قيمة الميل احسب ثابت سرعة التفاعل و 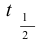
حيث 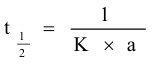
 الاكثر قراءة في مواضيع عامة في الكيمياء الفيزيائية
الاكثر قراءة في مواضيع عامة في الكيمياء الفيزيائية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


