
وزن معادلات الأكسدة والاختزال Balancing of Oxidation Reduction Equation:
 المؤلف:
أ. د محمد مجدي واصل
المؤلف:
أ. د محمد مجدي واصل
 المصدر:
اسس الكيمياء التحليلية
المصدر:
اسس الكيمياء التحليلية
 الجزء والصفحة:
ص 211-213
الجزء والصفحة:
ص 211-213
 2023-09-19
2023-09-19
 3739
3739
إن وزن المعادلة تعتمد على معرفة عدد الإلكترونات المتبادلة فلنأخذ مثلاً التفاعل بين أيونات البرمنجنات وبيروكسيد الهيدروجين في محيط حامضي فالمعادلات الآتية :

تعد شكلياً صحيحة جميعها ، فعند الذرات والتبدلات متساوية على الجانبين في كل هذه المعادلات . وفي الحقيقة، فإن واحدة من هذه المعادلات ( الثالثة ) هي صحيحة حقاً وتعبر كمياً عن هذه العملية بصورة كافية ، فإذا ما اخترنا خطوات التأكسد والاختزال بصورة منفصلة ، فإن المعادلة الثالثة فقط تعطي عدداً متساوياً من الالكترونـــات فـــي الخطوتين .
ولكي يتم وزن المعادلات التأكسدية - الاختزالية يجب أن نكتشف عدد الالكترونات التي يفقدها العامل المختزل والتي يأخذها أو يكتسبها العامل المؤكسد وهذا يسهل عمله إذا ما عرفت معادلات تفاعل نصف الخلية للمنظومة التأكسدية والاختزالية المعينة . ففي المثال المذكور آنفاً إذا ما كتبنا معادلتي نصف الخلية .
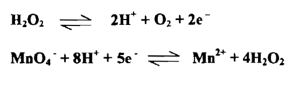
فإننا نستطيع أن نري حالاً 5 جزيئات فوق أكسيد الهيدروجين ستعطي 10 الكترونات والتي يأخذها أيونان من البرمنجنات ومن هذه النسبة يمكن موازنة المعادلة موازنة سهلة تامة وعامة أن وزن المعادلات التأكسدية - الاختزالية ينبغي أن تجري على وفق الخطوات الآتية :
1- تعيين نواتج التفاعل
2- وضع تفاعلي التأكسد والاختزال بمعادلات تفاعل نصف الخلية.
3- اضرب كل معادلة نصف خلية بمعامل بحيث يكون كل من المعادلتين يحتوي على نفس العدد من الالكترونات .
4- أخيراً اجمع هذه المعادلات واحذف المواد التي تظهر على جانبي المعادلة الناتجة . ومن الممكن توضيح العمليات المذكورة بالأمثلة الآتية :-
مثال توضيحي :-
صف التفاعل الذي يجري بين Sn+2, Fe+3
أ- يجب أن نعرف بأن النواتج هي Sn+2 Fe+3
ب- تفاعلات نصف الخلية هي كما يأتي :
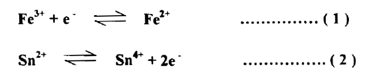
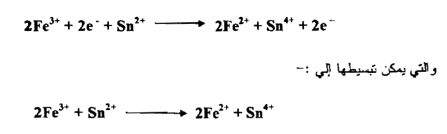
جـ - إذا ضربنا المعادلة ( 1 ) بالعدد 2 وجمعنا المعادلتين نحصل على المعادلة الآتية :
 الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


