
تفاعلات الأكسدة والاختزال Oxidation - Reduction Reactions
 المؤلف:
أ. د محمد مجدي واصل
المؤلف:
أ. د محمد مجدي واصل
 المصدر:
اسس الكيمياء التحليلية
المصدر:
اسس الكيمياء التحليلية
 الجزء والصفحة:
ص 209- 211
الجزء والصفحة:
ص 209- 211
 2023-09-18
2023-09-18
 3144
3144
عملية التأكسد هي العملية التي ينتج عنها فقدان في واحد أو أكثـر مــن الكترونات مادة ( ذرة ، أيون أو جزيئة ) . فعندما يتأكسد العنصر تتغير حالته التأكسدية ( تكافؤه ) إلى عدد موجب أعلى . وعامل التأكسد Oxidizing agent هو تلك المادة التي تكتسب الإلكترونات وهي بدورها تختزل في أثناء العملية .
أما الاختزال : فهي العملية التي ينتج عنها اكتساب المادة المتفاعلة ( ذرة ، أيون جزيئة ) واحداً أو أكثر من الإلكترونات . فعندما يختزل عنصر تتبدل حالته التأكسدية ( تكافؤه ) إلى قيم موجبة أصغر من السابق والعامل المختزل Reducing agent هو المادة التي تفقد واحداً أو أكثر من الكتروناته ويصبح مؤكسداً Oxidized
1 - التفاعل بين أيون الحديد الثلاثي (Fe (III والقصدير الثنائي (Sn (II ينتج حديد ثنائي ( Fe ( II وقصدير رباعي (Sn (IV

فإذا ما جري التفاعل بوجود حامض الهيدروكلوريك فيمكن ملاحظة اختفاء اللون الأصفر ( الذي يميز الحديد الثلاثي ) بسهولة مما يدل على تحوله إلي الحديد الثنائي . وفي هذه الحالة اختزال +Fe3 إلى +Fe2 و Sn+2 تأكسد إلى Sn+4، والذي حدث بالحقيقة أن الـ Sn+2 يعطي الكترونات إلي +Fe3 أي حدث انتقال في الالكترونات .
2- إذا وضع الحديد في محلول كبريتات النحاس ، فإنه يتغطى بطبقة من النحاس ويتكون أيون الحديد الثنائي
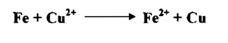
هذه الحالة يعطي فلز الحديد الكترونات إلي أيون النحاس الثنائي . فيصبح الحديد متأكسداً إلي Fe ويختزل أيون النحاس الثنائي إلي فلز النحاس .
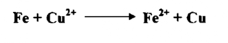
3- إن عملية ذوبان فلز الزنك في حامض الهيدروكلوريك هي أيضاً عملية تأكسد واختزال

إذ اكتسب أيون الهيدروجين الكترونات أخذها من فلز الزنك ، فتحول إلى جزيئة الهيدروجين عديمة الشحنة ) أي اختزال ) ، في حين تأكسد فلز الزنك إلي أيونات الزنك
ويمكن كتابة التفاعلات التي سبق ذكرها علي شكل تفاعلين منفصلين يمثل أحدهما التأكسد ويمثل الآخر الاختزال .
1- فالتفاعل بين أبون الحديد الثلاثي وأيون القصدير الثنائي .

2 -التفاعل بين فلز الجديد وأيونات النحاس

فالالكترونات المنطلقات من فلز الحديد أخذهما في هذه العملية .
3- ذوبان الزنك في الحامض

وهناك كذلك أخذ أيونا الهيدروجين الإلكترونين اللذين فقدها الزنك.
 الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


