


 الفيزياء الكلاسيكية
الفيزياء الكلاسيكية
 الكهربائية والمغناطيسية
الكهربائية والمغناطيسية
 علم البصريات
علم البصريات
 الفيزياء الحديثة
الفيزياء الحديثة
 النظرية النسبية
النظرية النسبية
 الفيزياء النووية
الفيزياء النووية
 فيزياء الحالة الصلبة
فيزياء الحالة الصلبة
 الليزر
الليزر
 علم الفلك
علم الفلك
 المجموعة الشمسية
المجموعة الشمسية
 الطاقة البديلة
الطاقة البديلة
 الفيزياء والعلوم الأخرى
الفيزياء والعلوم الأخرى
 مواضيع عامة في الفيزياء
مواضيع عامة في الفيزياء|
أقرأ أيضاً
التاريخ: 2023-10-04
التاريخ: 3-7-2016
التاريخ: 2023-12-14
التاريخ: 2023-12-03
|
تتمتع العناصر الموجودة على يمين الجدول الدوري بمستوى عال من طاقة التأين بحيث إنها إذا شاركت بمفردها في تكوين رابطة، لا تتحول خسارة الطاقة إلى مكسب أبدًا. حدد علماء الكيمياء الفيزيائية طريقة أخرى تستطيع بها الذرات أن تكون روابط بعضها مع بعض، لا سيما إذا أبت العناصر المشابهة الموجودة على يمين الجدول التخلي عن الإلكترونات وتكوين كاتيونات. لذا، تتوصل تلك الذرات لحل وسط : إنها «تشارك» إلكتروناتها وتكون ما يُعرف بـ «الرابطة التساهمية».
وهنا يجب أن أتراجع خطوة إلى الوراء قليلا بعيدًا عن هذه النقطة المتقدمة قبل الخوض في شرح مفهوم الرابطة التساهمية ونتائجها، وأوضح نقطتين. أولا، أشدد على أهمية مقطع Valent في المقابل الإنجليزي لكلمة تساهمية Covalent. فهو مشتق من الكلمة اللاتينية التي تعني «قوة» (Valete هي تحية الوداع الرومانية وتعني «كن قويا!») أصبحت كلمة valence – التي تعني التكافؤ – الآن مصطلحا كيميائيا شهيرًا في علم الكيمياء يشير إلى النظرية المعنية بتكوين الروابط. والمقطع co يشير إلى التعاون بين الذرات لتحقيق قوة الترابط.
ثانيًا، من الصعب تحديد اللحظة التاريخية التي أصبحت فيها الكيمياء الفيزيائية تخصصًا مميزا قائمًا بذاته داخل الإطار العام لعلم الكيمياء. بالتأكيد، كان هناك علماء كيمياء فيزيائية في القرن التاسع عشر؛ من بينهم مايكل فاراداي بل وروبرت بويل أيضًا الذي عاش في وقت سابق عن ذلك تحديدًا في القرن السابع عشر، على الرغم من أنهم لم يستخدموا المصطلح آنذاك. ورغم ذلك، ظهر أحد فروع الكيمياء الفيزيائية في مطلع القرن العشرين مباشرة عندما صار الإلكترون (المكتشف عام 1897) عنصرا أساسيا في تفسير الظواهر الكيميائية، وربما تتمثل نقطة انطلاق جيدة لهذا الفرع من التخصص في تحديد الرابطة التساهمية. ويرجع الفضل في هذا إلى الكيميائي الأمريكي جيلبرت لويس (1875–1946) الذي اقترح في عام 1916 أن الرابطة التساهمية عبارة عن تشارك زوج من الإلكترونات. ويُعد عدم حصول جيلبرت لويس على جائزة نوبل رغم إسهاماته العديدة والمؤثرة في علم الكيمياء بوجه عام وفي الكيمياء الفيزيائية بوجه خاص واحدًا من فضائح التاريخ الفكري.
كما أشرت آنفًا، الرابطة التساهمية عبارة عن تشارك زوج من الإلكترونات. فإذا كان للذرة طاقة تأين عالية جدًّا بحيث يصعب معها تكون كاتيونات بسبب الطاقة اللازمة لذلك، فلربما اكتفت بالتخلي جزئيا عن سيطرتها على أحد الإلكترونات. علاوة على ذلك، ربما تستعيد قدرًا من هذا الاستثمار الضئيل للطاقة من خلال التشارك في إلكترون توفره ذرة أخرى ذات سلوك مشابه شريطة انخفاض مستوى الطاقة بشكل عام. لقد استخدمت عمدًا مفردتين تشبيهيتين خاصتين بالبشر، «اكتفت» و «سلوك مشابه»، نظرًا إلى أن مثل هذه المفردات عادةً ما تتسلل إلى محادثات الكيميائيين كمختصرات لما يقصدونه فعلًا، وهي الإشارة إلى التغيرات الحادثة في الطاقة المصاحبة لإعادة توزيع الإلكترونات. سأتجنب استخدامها مستقبلًا ؛ لأنها غير دقيقة وغير مناسبة (ولكنها عادةً ما تكون جذابة على نحو غريب وتشبه كثيرًا المحادثات غير المتكلفة، وبالتالي تساعد في تجنب التناول المتحذلق).
وعلى عكس الرابطة الأيونية، تتمثل السمة الرئيسية المميزة للرابطة التساهمية في أنها ظاهرة «موضعية». والمقصود من هذا أنه نظرًا إلى أن الإلكترونات تجرى مشاركتها بين الذرات المتجاورة، فتحدث رابطة محددة بين تلك الذرات ولا تتوزع الإلكترونات على عدد لا يحصى من الأيونات وإحدى نتائج هذه السمة الموضعية هي أن ما ترتبط برابطة تساهمية هي جزيئات مفردة، مثل الهيدروجين: H2 (H – H)، والماء: 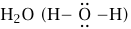 وثاني أكسيد الكربون: (CO2 (O=C=O وضربت مثالاً بهذه الجزيئات الثلاثة لسبب معين.
وثاني أكسيد الكربون: (CO2 (O=C=O وضربت مثالاً بهذه الجزيئات الثلاثة لسبب معين.
أولًا، يُظهر جزيء الهيدروجين H2 أن ذرات العنصر نفسه قد ترتبط بعضها ببعض برابطة تساهمية. وهذا الشكل من العناصر شائع بين اللافلزات (تأمل الأكسجين O2 والكلور Cl2). وتبين الصيغة H–H كيف يرمز الكيميائيون إلى الروابط التساهمية؛ أي إنهم يستخدمون شرطة بين الذرات المترابطة. وتشير كل شرطة إلى زوج متشارك من الإلكترونات. وجزيء الماء هو H2O، وقد ذكرته لأبين أنه لا يجب لجميع الإلكترونات التي تمتلكها إحدى الذرات أن تشارك في تكوين الرابطة التساهمية وأنه من خلال تكوين رابطتين تكون ذرة الأكسجين مُحاطة بثمانية إلكترونات (أي، أربعة أزواج). وتُسمى الأزواج غير المستخدمة «الأزواج الوحيدة». وتشير حقيقة وجود ثمانية إلكترونات إلى أن ذرة الأكسجين كونت أكبر عدد ممكن من الروابط إلى أن وصلت إلى ما رأيناه بالفعل بوصفه أقصى سعة للغلاف الخارجي للإلكترونات الخاص بها. هذا «التكوين الثماني» كما يُطلق عليه هو أحد المبادئ الإرشادية غير الجديرة بالثقة دومًا، لتكوين الروابط. وأخيرًا، ذكرت مثال ثاني أكسيد الكربون لأنه يوضح أنه يمكن لأكثر من زوج واحد من الإلكترونات أن تجري مشاركته بين ذرتين؛ والرمز = يشير إلى «رابطة مزدوجة»، تتكون من زوجين متشاركين من الإلكترونات. هناك أيضًا جزيئات ذات روابط ثلاثية (ثلاثة أزواج متشاركة)، ونادرًا جدًّا ما تكون هناك روابط رباعية.
وليست جميع الأشياء المترابطة برابطة تساهمية هي جزيئات منفردة. فمن الممكن في بعض الحالات أن يسفر تكوين الروابط التساهمية عن شبكات موسعة من الروابط. ويعد الألماس أشهر مثال على ذلك، حيث إن كل ذرة كربون تكون رابطة أحادية مع أربع ذرات مجاورة، وكل ذرة من هذه الذرات ترتبط بجاراتها من الذرات وهكذا عبر البلورة.



|
|
|
|
4 أسباب تجعلك تضيف الزنجبيل إلى طعامك.. تعرف عليها
|
|
|
|
|
|
|
أكبر محطة للطاقة الكهرومائية في بريطانيا تستعد للانطلاق
|
|
|
|
|
|
|
العتبة العباسية المقدسة تبحث مع العتبة الحسينية المقدسة التنسيق المشترك لإقامة حفل تخرج طلبة الجامعات
|
|
|