


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 9-2-2017
التاريخ: 2024-03-05
التاريخ: 9-2-2017
التاريخ: 2024-02-19
|
يُعد مركب الإيثيلين الشائي الأمين رباعي حمض الخليك EDTA معقداً ممتازاً، ويكون مع أيون المعدن شكلاً مخلبياً، وبدل استخدام EDTA القليل الذوبان يستخدم ملحه الصوديومي YNa2H2 ، ويوجد في هذا المركب ست ذرات قابلة لتكوين روابط تساهمية مع ذرة المعدن المركزية، ويتكون نتيجة لذلك مركب خماسي الحلقة، ويتفاعل EDTA مع أيونات المعدن بنسبة 1:1؛ أي أن عدد مولات أيون المعدن تساوي عدد مولات EDTA عند اكتمال التفاعل. إذن Al+3 ، Mg+2 ، Ca+2 كلها تتفاعل بالنسبة نفسها (1:1).
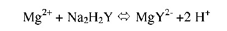
ويتضح من هذه المعادلة أن تأين المركب المعقد يعتمد على درجة حموضة الوسط، أي إذا ما زاد تركيز أيون الهيدروجين فإن التفاعل سيسير في اتجاه عكسي يؤدي إلى تفكك المركب المعقد، لهذا يجب أن يكون الوسط قاعدياً 7< pH عند معايرة الأيونات التي تكون معقدات ضعيفة (قابلة للتفكك) مثل +2 Ca ، +2Mg ، في حين يمكن معايرة أيونات Ni ، Zn2 في وسط حمضي؛ لأن هذه الأيونات تكون مركبات معقدة عالية ،الثبات لهذا تجري معايرات EDTA وجود محاليل منظمة لدرجة الحموضة (Buffers).
إن المادة المستخدمة كدليل في معايرة المعقدات هي عبارة عن أصباغ عضوية تتفاعل مع عدة أيونات من المعادن، ويجب أن يكون المعقد المتكون من أيون المعدن ومادة الدليل معقداً أقل ثباتاً من المعقد المتكون من أيون المعدن والـ EDTA ، وذلك حتى ينتهي التفاعل بين EDTA وأيون المعدن، وعند نقطة النهاية يتفاعل الأيون الناتج من تفكك المعقد مع مادة الدليل فيتكون بذلك معقد له لون مميز نستطيع بواسطة هذا اللون تحديد نقطة النهاية.


|
|
|
|
التوتر والسرطان.. علماء يحذرون من "صلة خطيرة"
|
|
|
|
|
|
|
مرآة السيارة: مدى دقة عكسها للصورة الصحيحة
|
|
|
|
|
|
|
نحو شراكة وطنية متكاملة.. الأمين العام للعتبة الحسينية يبحث مع وكيل وزارة الخارجية آفاق التعاون المؤسسي
|
|
|